- PDNレクチャーとは?
- Chapter1 PEG
- Chapter2 経腸栄養
- 1.経腸栄養の特徴と適応
- 2.経腸栄養剤の分類
- 3.病態別経腸栄養剤
- 3.1 病態別経腸栄養剤とは?
- 3.2 肝不全用栄養剤
- 3.3 腎不全用栄養剤
- 3.4 糖尿病用栄養剤
- 3.5 呼吸不全用栄養剤
- 3.6 免疫賦活栄養剤、免疫調節栄養剤
- 4.経腸栄養に用いられる製剤および食品
- 4.1 グルタミン製剤(食品)
- 4.2 微量元素製剤
- 4.3 食物繊維
- 4.4 プロバイオティクス、シンバイオティクス
- ① プロバイオティクス
- ② シンバイオティクス
- 4.5 ORS(経口補水液)
- 4.6 増粘剤、ゲル化剤
- 4.7 脂肪酸
- ① 脂肪酸とその分類
- ② 多価不飽和脂肪酸(ω-3, ω-6系)
- ③ 中鎖脂肪酸(MCT)
- 5.半固形化栄養剤
- 5.1 基礎的な知識
- 5.2 臨床的な知識
- ①胃瘻からの半固形化栄養材
短時間注入法 - ②栄養剤形状機能について
- 6.ミキサー食
- 6.1 ミキサー食(成人)
- 6.2 ミキサー食(小児)
- 6.3 ミキサー食(小児)
- 7.早期経腸栄養
- 8.周術期経腸栄養
- 9.在宅経腸栄養
- 9.1 在宅経腸栄養
- 9.2 在宅診療の医療費の実際
- 9.3 終末期医療にかかる費用
- 10.経腸栄養に必要な器具
- 11.経腸栄養時の薬剤投与
- 12.経腸栄養の管理
- 13.経腸栄養の合併症と対策
- 14.栄養剤使用時の栄養アセスメント
- ●「経腸栄養」関連製品一覧
- Chapter3 静脈栄養
- Chapter4 摂食・嚥下リハビリ
- PDNレクチャーご利用にあたって




2025年2月2日改訂
手術患者を安全に、早期に回復させるためには、周術期の栄養管理が重要であることは言うまでもない。周術期は術前、術中、術後に分けられる。周術期の栄養管理とは、術前から術後にかけての栄養管理であるが、ここでは、術前と術後の経腸栄養療法に関して述べることとする。
近年、欧米の術後早期回復プログラムであるfast track surgery やERAS (Enhanced Recovery After Surgery)の普及で、とくに結腸癌術後の早期経口栄養が推奨され、欧米では術当日からの経口摂取も行われるようになってきている。さらに、当初は大腸癌に対してのERASであったが、現在その概念は幅の広い疾患、術式に応用され、消化器癌では大腸がん、胃がん、肝臓手術、膵臓手術、肥満手術など、また他の領域では整形外科、婦人科手術などでERASの有用性が確認されている。このような状況から消化器の術後栄養管理も早期からの経口栄養、すなわち食事が主体となってきている1,2)。しかし、すべての手術症例に、術当日、もしくは術後1日目から、の経口栄養が可能ではない。
また、術前からの低栄養状態や、侵襲の大きな手術で、経口摂取が不可能な場合などには、経腸栄養や静脈栄養が必要となる。ただ、いずれにせよ、術後経口栄養が主体となり経腸栄養や静脈栄養は徐々に術後合併症例や重症例に限って使用され、その適応範囲は狭まっていくと考えられる。
現在は、周術期栄養管理は経腸栄養、静脈栄養管理から経口栄養管理への移行期であり、個々の症例の病態を考慮し、どのような栄養管理がその症例に適切かを考えるのが大切といえる。
1.術前栄養管理と経腸栄養
1.1 術前の栄養スクリーニングとアセスメント
術前の患者の栄養状態は手術成績や術後経過に大きな影響を与える。そのため、術前の栄養状態のスクリーニングとアセスメントは臨床的に重要となる。本邦では主観的包括的評価法(subjective global assessment; SGA)が現在広く用いられてきた。また、最近は栄養アセスメントとしてGLIM基準も広く使われるようになり術前の評価にも用いられてきつつある。客観的評価としては、身体測定から割り出される体重、BMIの変化など、血液生化学検査の血清アルブミン値、RTP(rapid turnover protein)、末梢総リンパ球数などが用いられる。
NI(nutritional index)とは、複数の栄養指標を組み合わせることによって、より総合的、客観的に栄養状態を表すことを目的とした指標のことである。周術期患者の予後を推定するNIとして、我が国では小野寺指数といわれる、小野寺らのPNI(prognostic nutritional index:予後推定栄養指標)が広く用いられており、欧米でも認識されるようになっている。
PNI=10xAlb+0.005xTLC
Alb:血清アルブミン値(g/dl)、TCL;末梢総リンパ球数(/μL)
小野寺指数は血清アルブミン値と末梢総リンパ球数のみから計算されるため、非常に簡便である。とくに、食道癌や胃癌などの上部消化管手術における予後推定に利用され、45以上であると手術の制限なし、40~45は要注意、40以下は切除・吻合禁忌などとされる。
ヨーロッパを中心に術前の栄養スクリーニングはESPENが推奨するNRS2002 (Nutritional Risk Screening score)が使用されている3)
(表1-1)。これは体重減少、BMI、食事摂取量、病気の重症度、そして70歳以上かどうかの5項目で判定される。大規模な臨床研究でその有用性は確認されており、周術期の栄養サポートの必要性を判断する良い指標であるとされている。このスコアが3以上はリスクありと判定される。
|
軽度 |
中等度 |
高度 |
|
|---|---|---|---|---|
栄養状態 |
BMI |
|
18.5-20.5 |
<18.5 |
食事摂取量 |
50-75% |
25-50% |
<25% |
|
体重減少 |
3ヵ月 |
2ヵ月 |
1ヵ月 |
|
疾患手術重症度 |
軽度 |
中等度 |
高度 |
|
年齢 |
>70歳 |
|||
1.2 術前栄養管理の必要性とその対象
栄養障害を伴う手術症例では、術後の合併症の発生率や、死亡のリスクが高くなり、入院期間も長くなる。そのような患者に術前栄養療法を行うことは、術後の感染性合併症発症率の低下、在院期間の短縮、予後の改善に寄与する。術前栄養療法に必要な時間は、生理的な機能を回復させるためには4-7日間、さらに体内タンパク質の回復を目標とした場合は7-14日の栄養療法が必要と考えられている。ESPEN(欧州臨床栄養代謝学会)のガイドライン(ESPEN Guideline; Clinical nutrition in surgery, 2021)ではがん手術も含めてメジャーな手術を受ける患者で高度の栄養障害のリスクのある場合は、7日から14日間の術前栄養療法が推奨されている4)。
JSPEN(日本臨床栄養代謝学会)の静脈経腸栄養ガイドラインでは、術前に中等度ないし高度の栄養障害に陥っている患者には術前栄養療法の適応であるとされている5)。また、ESPENのガイドラインでは、以下の場合を術前のハイリスクとし、術前の栄養管理をおこなう具体的な適応が示されている4)(表1-2)。
|
術前栄養療法は、原則的には経口が基本となる。しかし、通常の食事摂取が困難な場合は経口補助栄養(ONS:oral nutritional supplements)として経腸栄養剤や濃厚流動食を経口摂取する。腹部のメジャーな手術を受ける低栄養患者、低栄養のハイリスク患者、とくに高齢者のサルコペニア患者にはONSを投与すべきとされている4)。それもできない場合には、経管栄養、さらに困難な場合は静脈栄養とする。食道がんにより食道狭窄があり、食事が困難な場合などに、細径の経鼻カテーテルを挿入・留置し、術前経腸栄養による栄養状態の改善を行うことはしばしば経験される。
1.3 術前の免疫調節経腸栄養剤によるimmunonutrition
生体の免疫能や防御能を増強もしくは調節するとされる特定の栄養素(n-3系不飽和脂肪酸、アルギニン、グルタミン、核酸など)が強化された免疫調節栄養剤(immune-modulating diet:IMD)を用いて、感染を予防、入院期間の短縮、死亡率の低下などの臨床的アウトカムの改善を目的とする栄養療法をimmunonutritionと呼ぶ。抗酸化ビタミン(ビタミンC,E)、微量元素(亜鉛、セレンなど)、ポリフェノールなどの抗酸化物質や、腸内環境を改善するプロバイオティクス、プレバイオティクスなどもimmunonutritionの栄養剤の成分といえる。
IMDの従来の投与方法は、待機手術症例に術前5-7日、1日1000mlを経口投与する。これに加えて、術後にも、早期経腸栄養として5-7日用いることも行われる。栄養障害のない患者では、術前投与だけでも効果が期待できるとされてきた。現在、消化器外科のメジャーな待機手術にはルーチンでimmunonutritionを行うことを推奨する報告もある6)。
Immunonutritionの期待される効果としては、①感染性合併症発生率の減少(約50%程度)、②在院日数、抗生物質使用量、人工呼吸管理期間、多臓器不全の減少、などがあげられており、医療費に関しても,医療費の節約効果があったと報告されてきた7)。
しかし、最近では、その効果が疑問視される研究結果が数々報告され、現在では、少なくとも、免疫栄養は対象としてメジャーな待機手術が行われる低栄養患者の周術期には効果があると考えられている。また、術前の5-7日間のIMDの投与が推奨されているものの、術前におけるIMD経口摂取と標準栄養剤の経口摂取の術後のアウトカムに差があるというエビデンスはないとされている8)。
特に最新のESPENのガイドラインでは「メジャーながん手術を受ける低栄養患者には術前術後、もしくは最低でも術後にIMDの使用を勧める。術前のみの使用はスタンダードなONSとはっきりした差はない」とされている4)。
重症敗血症状態にIMDを投与すると死亡率を増加させる可能性があることが報告され、その原因がIMDに強化されているアルギニンによる過剰な炎症反応が原因ではないかと考えられている9)。その機序は,アルギニンはNOの前駆物質で,敗血症時などではNOS(一酸化窒素合酵素)の活性が高まり,そこに大量のアルギニンが投与されると,過剰なNOが産生され,活性酸素による組織障害と血管拡張による血圧低下を助長すると考えられている。現在は、敗血症患者に対してのアルギニン投与は.不適切と考えられている。
現在、本邦でIMDの代表格であったインパクト(ネルレ)は主倍となっている。。
1.4 シンバイオティクス
腸内細菌叢を正常化、もしくは改善する目的で投与される、プロバイオティクスとプレバイオティクスが周術期でも注目されている。プロバイオティクスは宿主に有益に働く生きた細菌によって構成される製剤で、Lactobacillus属, Bifidobacterium属、Saccharomyces属、もしくはその混合などが使用されている。プレバイオティクスは、大腸腸内細菌の善玉菌を増殖させるか、悪玉菌の増殖を抑制することで、宿主に有益な効果をもたらす、難消化性食品成分のことで、オリゴ糖や一部の食物繊維などがそれにあたる。その両者を併用するのがシンバイオティクスであり、周術期にシンバイオティクスを利用することにより、術後感染症の発生が抑制されることが報告されている。
侵襲の大きな胆道癌手術において、術後14日間、ビフィズス菌、乳酸菌とガラクトオリゴ糖を投与し、術後感染性合併症が有意に減少した。さらに、術前にも投与することで、術後のみの投与よりも有意に術後感染症が減少したことが報告されている10,11)。また、食道がんや肝がん手術においてもシンバイオティクスの効果が報告されている12)。今後、期待される術前術後管理である。
1.5 プレハビリテーション
プレハビリテーションには術前栄養管理がその一つの項目となっている。プレハビリテーションは、運動療法を中心に、栄養や精神面のアプローチも加えた多職種で行うマルチモーダルな術前介入である13)。患者の術前教育や禁酒・禁煙などの指導も行う。主な目的は、運動療法による術前の心肺機能や筋力、全身の代謝機能を向上と、それによる術後の回復の促進、合併症発生の予防、入院期間の短縮などである。術後早期回復プログラムのERASの一環でもあり、肺や食道、心臓の手術などのERASガイドラインでは推奨項目の一つとなっている14)。実際には、リハビリテーション職員による筋力トレーニング、有酸素運動、管理栄養士による栄養指導、看護師などによる術前教育、禁煙・禁酒の指導などが行われる。特に、術後経過にリスクがある高齢者やサルコペニア、フレイルを呈する手術患者に対して行われる。
2.術後栄養管理と経腸栄養
手術による侵襲により、術後は体内の代謝が変化する。エネルギー消費量の増加、骨格筋蛋白の崩壊、肝臓の糖新生や急性相タンパクの合成亢進、インスリン抵抗性の増大と高血糖、脂肪分解の亢進などが挙げられる。このような病態に対応するために、術後早期から適切な栄養管理を行うことが重要で、術後合併症の減少、手術成績の向上、手術侵襲からの速やかな回復が望まれる。
2.1 術後経腸栄養の適応と利点
一般的には、以下のような症例に対し術後の積極的な栄養管理を行うとされる。
- 術後、経口摂取が1週間以上にわたり制限されるような侵襲の大きな手術を受けた場合
- 術前より低栄養状態のある場合
- 術後合併症が発生した症例
一方、ESPENのガイドラインでは、以下のような場合に周術期の栄養療法(経腸栄養や静脈栄養)が遅れることなく行われることが推奨されている4)。
①周術期に5日以上の絶食となる場合
②周術期に経口摂取量が必要エネルギー量の50%以下が7日間以上続く場合
一般的に経腸栄養は多くの点で静脈栄養より利点がある。その利点として、1)腸管粘膜の維持(腸管粘膜の萎縮の予防)、2)免疫能の維持、bacterial translocationの回避、3)代謝反応の亢進の抑制(侵襲からの早期回復)、4)胆汁うっ滞の回避、5)消化管の生理機能の維持(腸蠕動運動、消化管ホルモン分泌)、6)カテーテル関連血流感染症(カテーテル敗血症)、気胸などのTPN時の合併症がない、7)長期管理が容易である、8)廉価である、などがあげられる(表2)。とくに、静脈栄養で、消化管を使用しないでいると、腸粘膜の萎縮に伴い、そのバリア機能が失われ、bacterial translocationがおこると考えられている。
|
一方、経腸栄養で腸を使うことで、腸のバリア機能、免疫能が維持されbacterial translocationが回避できると考えられている。
消化管やその周囲にはリンパ球などの免疫担当細胞が全体の50~80%集まっており、消化管は人体の中で最も重要な免疫臓器でもある。経腸栄養により腸管とその免疫能を刺激することは、腸管免疫ばかりでなく全身の免疫能を腑活化すると考えられる。多くの論文で、早期経腸栄養を行った症例はTPN症例に比較し、感染性合併症が約5割程度少なくなるという結果が得られている15)。
また、周術期の経腸栄養と静脈栄養を比較した論文からも経腸栄養の優位性が指摘されている。Mazakiらが報告したメタ解析では、経腸栄養の方が感染性合併症、吻合部の縫合不全が少なく、在院日数も短縮するとされ、Zhaoらのメタ解析の報告でも排ガスまでの時間や在院日数が短縮され、アルブミン値も上昇するとされる4)。
そのため、積極的栄養管理の必要な場合の栄養投与経路は、経腸栄養・経口栄養を原則的に第一選択とされる4)。ただし、最近の重症患者を扱った報告では、静脈栄養施行例に対し、血糖などを含め厳しく管理すれば、合併症の頻度は静脈栄養でも経腸栄養と変わらないとする報告も見られている16)
術後栄養管理として、経口摂取が可能なら経口的に行うのが原則だが、経口が不可能もしくは目標エネルギー量の60%以下しか摂取できない場合には、経管栄養を追加する。消化管が安全に使用できない場合のみ静脈栄養を行うことを原則とする。ESPENのガイドラインでは、消化管が安全に使用できない場合として、①腸閉塞やイレウス、②ショック状態、③腸の虚血、④high outputの腸瘻、⑤重症な消化管出血、が挙げられている4)。
このような場合は静脈栄養が優先される。JSPENのガイドラインでは「術後はできるだけ早期からの食事、あるいは経腸栄養を開始する。ただし、個々の状態や術式を考慮する」と記載されている3)。
術後に7日間、経口もしくは経腸栄養で必要エネルギー量の50%以下しか投与できない場合は,静脈栄養との併用を考慮すべきである4)。
2.2 術後経腸栄養管理のためのアクセスルート
消化器手術患者に術後経腸栄養管理を行うためには、経腸栄養を行うアクセスルートを確保する必要がある。経鼻栄養カテーテルを利用する場合もあるが、多くは手術時に空腸瘻を造設する。開腹手術などで侵襲が加わると、腸管の蠕動運動は一時的に抑制されるが、小腸は術後数時間で、胃は24時間前後、大腸は数日後にその運動が回復する。術後早期に経腸栄養を開始する場合は、すぐに運動が回復する空腸にカテーテル先端を留置することが望ましい。
1)経鼻栄養カテーテル
手術中に経鼻栄養カテーテルを挿入し、空腸内に誘導する。胃全摘では吻合部を通過させて先端を挙上空腸に誘導する
(図1)。
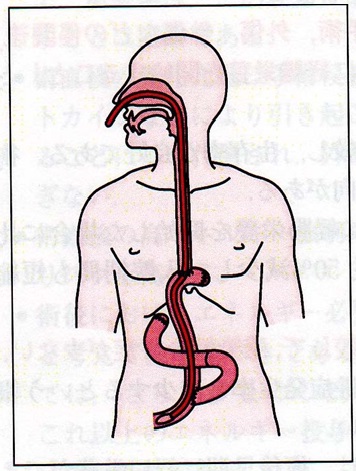
手術時に入れる経鼻栄養カテーテルは操作しやすいように、こしがあるもののほうが扱いやすい。経鼻栄養カテーテルは短期間の使用に使われ、長期に経腸栄養補助が必要な場合は空腸瘻を造設する。
2)手術的な空腸瘻造設法
消化器外科領域では手術時に手術後の栄養管理目的に空腸瘻が造設される(図2)とくに上部消化管手術や膵臓の手術時に行われるケースが多い。直接、空腸にカテーテルを挿入する場合の他、残胃を通して十二指腸、空腸にカテーテル先端を留置する場合もある。
空腸瘻造設法には、①腸管をカテーテルが貫く部位が直接腹壁に開口した直接瘻(Stamm式)、②腸管をカテーテルが貫く部位と腹壁を貫く部位との間に一定の長さの瘻管を有する間接瘻(Wizel式)、③キットを使う針付きカテーテル法(Needle Catheter Jejunostomy、NCJ)などの方法がある17)。
①Stamm式空腸瘻造設術
(図3a)
空腸の腸間膜対側にタバコ縫合をかけ、その中心部の腸管に切開を加え、カテーテルを肛門側に向かい挿入、タバコ縫合し縫縮結紮する。再度カテーテル挿入部周囲にタバコ縫合をかけ結紮する。腹壁を貫き、カテーテルを体外に誘導し、カテーテル挿入部位と腹壁を2〜4針結紮縫合し、固定を行う。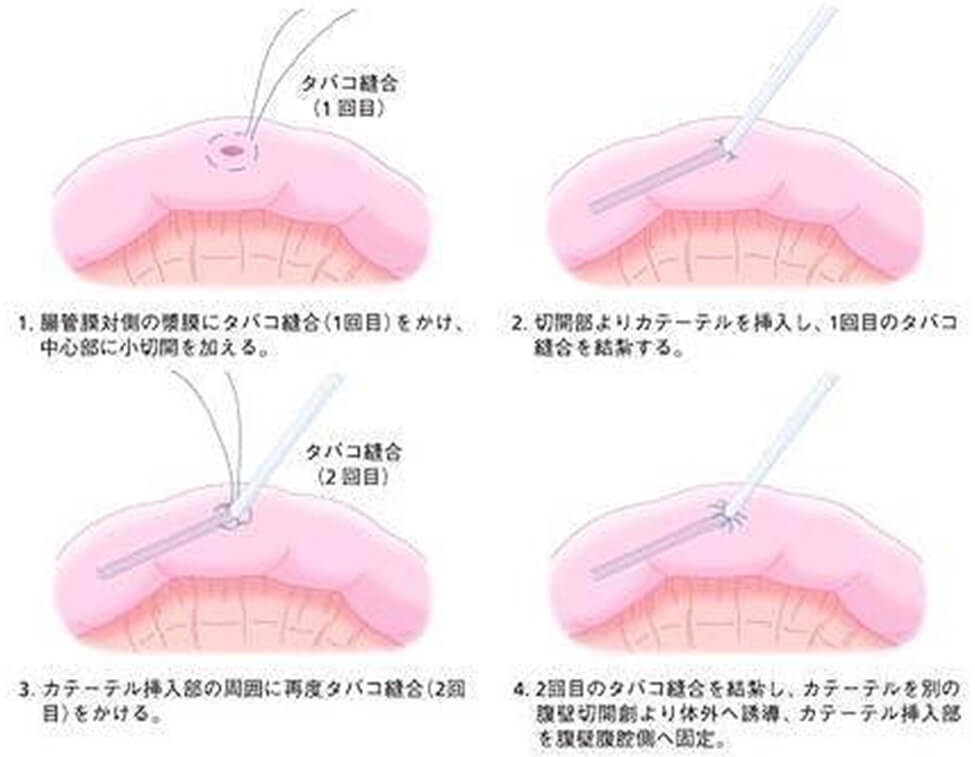
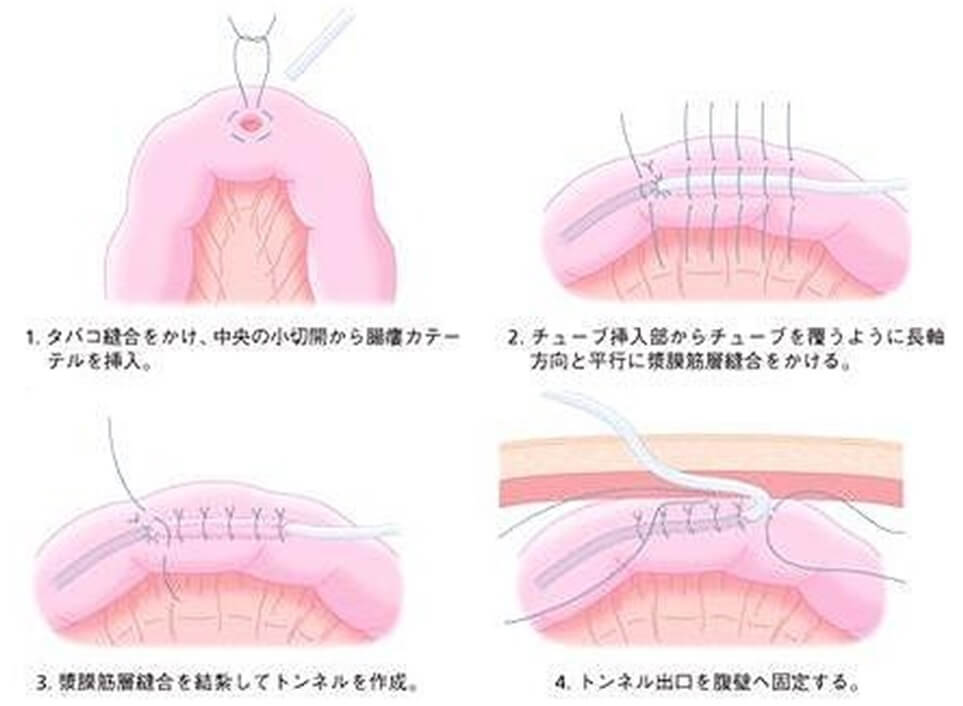
②Wizel式空腸瘻造設術(図3b)
空腸の腸間膜対側にタバコ縫合をかけ、その中心部の腸管に切開を加え、カテーテルを肛門側に向かい挿入、タバコ縫合を縫縮結紮する。挿入部より腸管外のカテーテルを長軸方向に覆うように漿膜筋層縫合を行い、トンネルを作成する。カテーテルを体外に誘導し、カテーテル挿入部位と腹壁を2〜4針結紮縫合し、固定を行う。
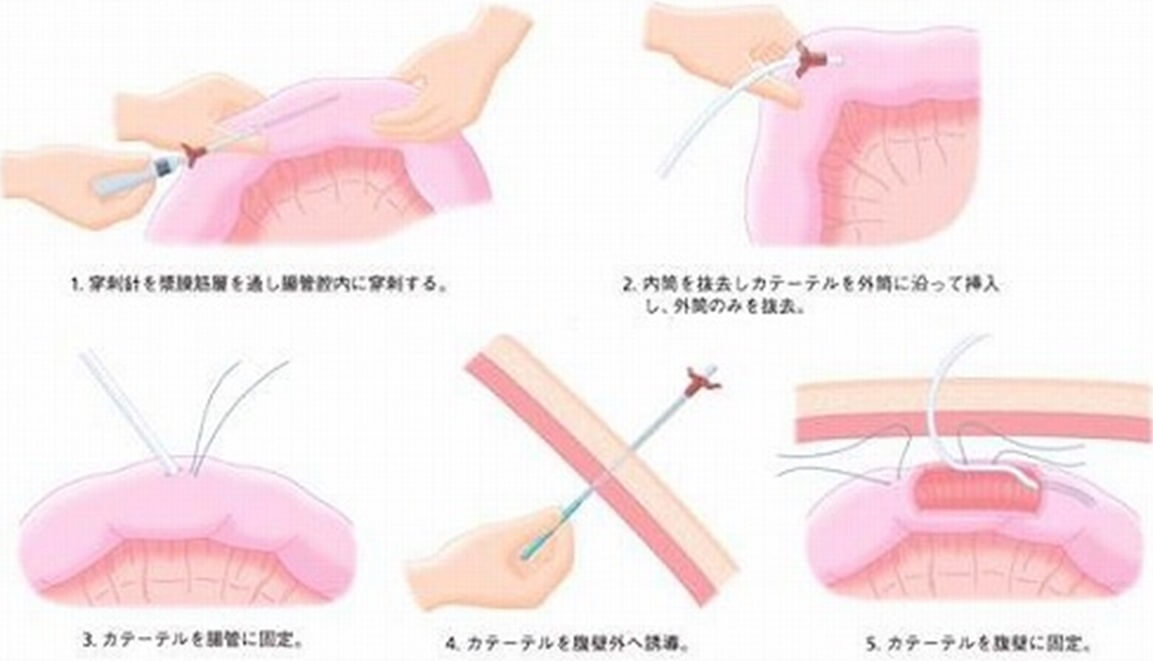
③針付きカテーテル法(Needle Catheter Jejunostomy, NCJ)(図3c)
NCJはキット製品として販売されており、挿入が簡便で挿入部位からの腸内容の漏出が最低限に抑えられるという利点がある(図4)。空腸の腸間膜対側を穿刺針で漿膜筋層をややはうようにして、肛門側に向けて穿刺をおこなう。穿刺針の内筒を抜去し、外筒にそってカテーテルを腸管内に挿入する。外筒を抜去して、カテーテルを腸管に縫合固定の後、カテーテルを体外に誘導し、カテーテル挿入部位と腹壁を2〜4針結紮縫合して、固定を行う17)。
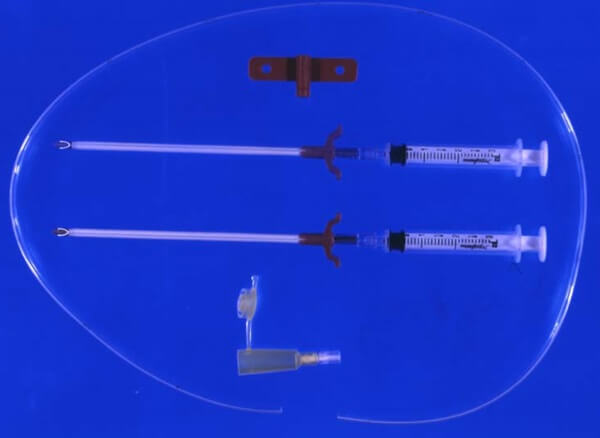
2本の穿刺針と9Frのカテーテル、アダプターなど
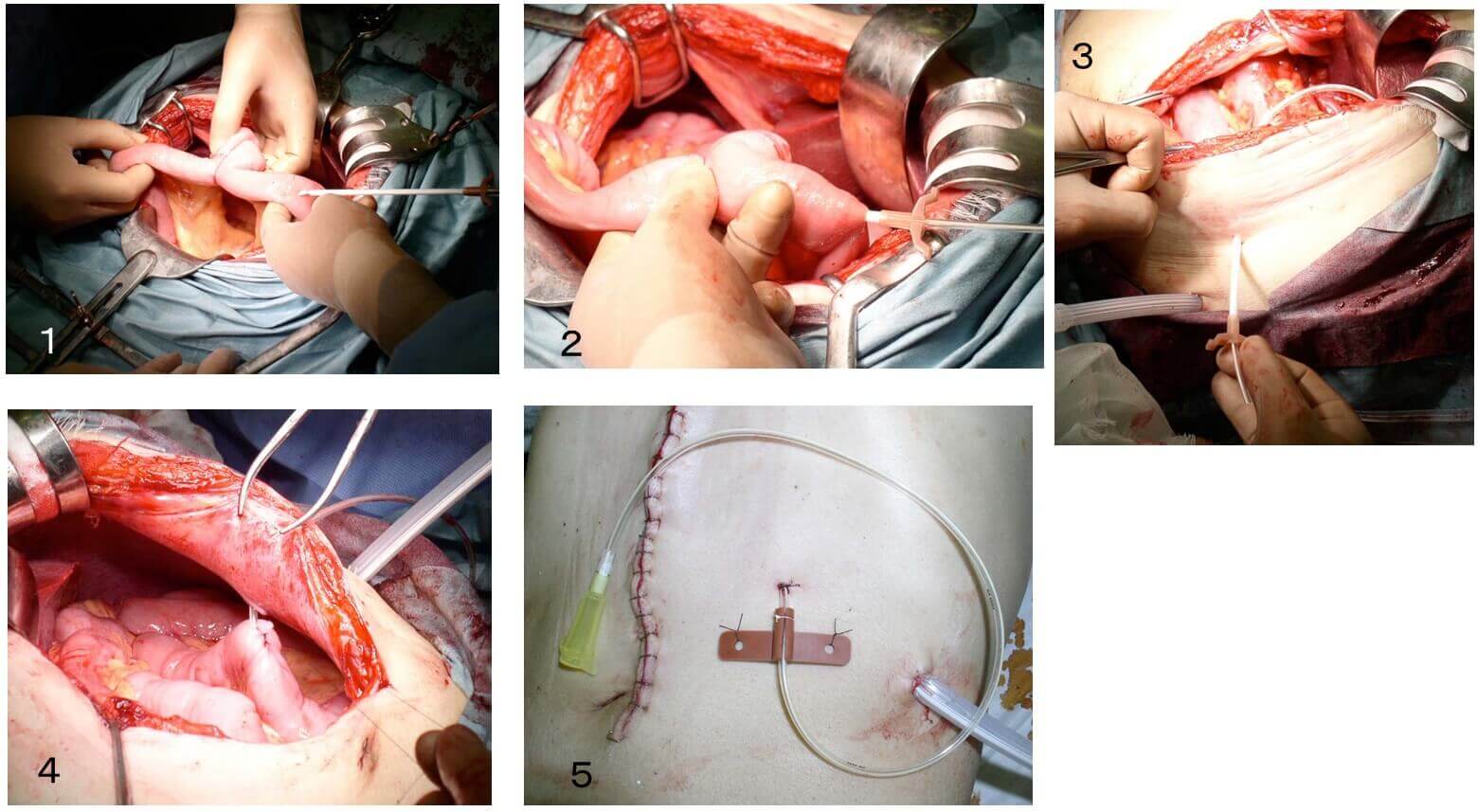
1、Roux-en Y吻合野Y脚より穿刺針を挿入、2、外套に沿ってカテーテルを吻合部を超えて 留置、3、カテーテルを腸に固定して、体外に引き出す、4、空腸瘻の部分の空腸と腹壁を 縫合する、5、出来上がったところ
3)各手術時の経腸栄養カテーテルの留置法
カテーテルの挿入部位は、食物が通過しない腸管から挿入し、カテーテルを進めて先端を食物が通過する空腸に留置するのを原則としている18)。挿入部の腸管は原則として腹壁と縫合するため、屈曲により内容物の通過が阻害される可能性があるからである。カテーテル挿入部の胃や空腸と腹壁が近接できず、縫合できない時は、肝円索の有茎弁を用いて、その中にカテーテルを通し、肝円索と腸管、肝円索と壁側腹壁を縫合する方法がある。カテーテルが腹腔内に露出して存在する事は極力避けるべきであると考える。
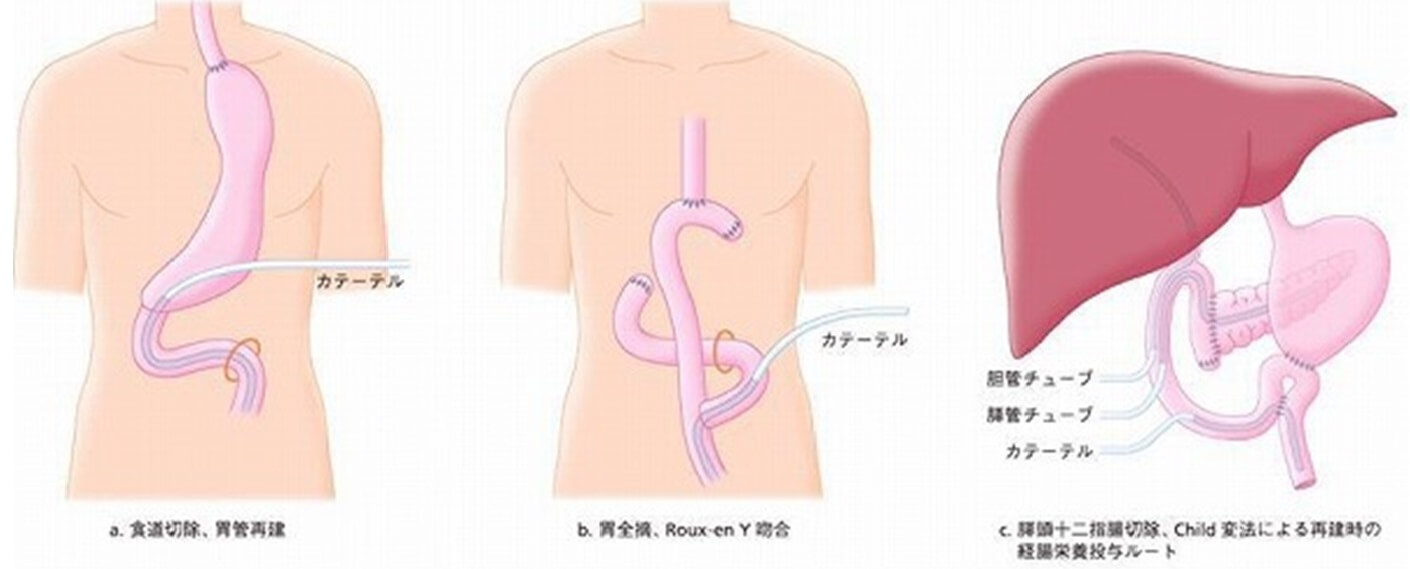
① 食道切除術:胸骨後胃管再建時には、胃管よりカテーテルを挿入し、幽門輪をこえて、十二指腸もしくはトライツ靱帯を越えて空腸にカテーテル先端を留置する(図2)。後縦郭再建では、近位空腸に直接カテーテルを挿入し、カテーテル挿入部の空腸と腹壁を固定している。
② 胃全摘術:Roux-en Y吻合では、空腸Y脚よりカテーテルを挿入し、Y吻合を越えてカテーテル先端を留置する(図2)。
③ 膵頭十二指腸切除術:Child変法での再建時は、膵空腸吻合、胆管空腸吻合のため挙上した空腸ループから挿入し、先端を吻合より遠位の空腸に留置している
(図2)。
4)開腹手術時における空腸瘻造設術の合併症
造設術の手技が原因となる合併症の代表は、腸閉塞である。カテーテル腸管刺入部を腹壁に固定するため、内ヘルニア状となるためである。著者の300例以上のNCJの経験で、1例のみ空腸瘻が原因のイレウスを認めたのみで、非常にまれである19)。その他の合併症としてそのほかにもカテーテルの事故抜去、カテーテル閉塞、空腸瘻腹壁感染、腸管壊死などの合併症が報告されている20)。2022例のNCJ合併症を扱ったMyersの報告では腹腔内管感染0.15%、腸管閉塞0.15%、腸管壊死0.15%、pneumatosis intestinalis 0.15%、腹壁感染0.25%、事故抜去とカテーテル閉塞0.74%と報告されており、手術的空腸瘻造設は安全な手技であるといえる21)。
5)術後の空腸瘻管理
術後、瘻孔部からの浸出液がある間は、ガーゼ交換をおこなう17)。術後1—2週間後には浸出液がなくなり、瘻孔部の発赤もなくなれば、シャワー、入浴は可能となる。シャワー、入浴時には、カバーしているドレッシングをはずし、石鹸を用いて瘻孔部周囲を洗浄するよう心掛ける。浸出液がなければ、ドレッシングの必要は無い。
空腸瘻カテーテルは8Fr-12Frと細く、経腸栄養剤が詰まりやすいので注意を要する。カテーテルの詰まりを防止するため、定期的なカテーテルのフラッシュが必要である。注射器を用い20-30ml水道水でフラッシュする。半消化態栄養剤、濃厚流動食の持続投与の場合は1日4回、成分栄養剤、消化態栄養剤の持続投与の場合は1日1-2回を原則とする17)。
2.3 術後早期経腸栄養の利点と実際
1)早期経腸栄養の定義と利点
早期経腸栄養の定義は「外科手術、外傷、熱傷などの侵襲後、24時間もしくは36時間以内に経腸栄養を開始すること」とされることが一般的である。術後早期経腸栄養は術後絶食と比較すると、生存率が良好であり、術後合併症、在院日数も減少傾向がある。早期経腸栄養は36時間以降に経腸栄養を開始した場合に比べても、感染性合併症が約50%減少し、入院期間も短縮すると報告されている22)。
1980年代から現在にかけて、静脈栄養と経腸栄養の臨床的比較が行われてきたが、早期の静脈栄養に比較して、早期経腸栄養は感染性合併症が少ないという報告が多い23)。また、入院期間や非感染性合併症も減少するという報告もある。しかし、多くの報告で、死亡率には差を認めていない。一方、2014年に発表されたCALORIEトライアルでは、ICU入室後36時間からEN群、PN群に20kcal/Kg/日程度の同等のエネルギーを5日間投与し、感染性合併症や死亡率は差がないことが示され、静脈栄養に比較し早期経腸栄養が必ずしも優位ではない可能性も示唆されている24)。また、前述したように最近の重症患者を扱った報告では、静脈栄養施行例に対し、血糖などを含め厳しく管理すれば、合併症の頻度は静脈栄養でも経腸栄養と変わらないとする報告も見られている。
術後早期経腸栄養の良い適応は、頭頚部がんや消化管がん、頭部外傷を含む重症外傷、手術時の重度な低栄養患者などとされる4)。
2)術後栄養管理のエネルギー、タンパク質量の目標
術後は、生体が必要とするエネルギーや免疫応答や創傷治癒に必要なエネルギーを得るために、生体内では異化が亢進し、貯蔵エネルギーの利用が促進される。筋タンパクの崩壊により得られたアミノ酸から糖新生が行われ、脂肪の加水分解も進行する。術直後の異化亢進は手術侵襲に対する生理的な反応から生まれる内因性エネルギーを考慮に入れて術後管理を行う必要がある。術直後の高エネルギー強制栄養は、むしろ血糖上昇をまねき、感染のリスクも高め、予後悪化につながると考えられる。
異化期に当たる術後の早期(術後3,4日)にはoverfeedingにならないように抑え気味のエネルギー投与が推奨される。以前の重症患者に関するESPENガイドラインでは、早期には20-25kcal/kg/dayが推奨されていた25)。最近のガイドラインでは、間接熱量計での測定が推奨され、早期には測定された消費熱量の70% 以下のエネルギー量とされ、熱量計の測定ができず、予想式で算出された場合もその算出値の70%以下に抑えて投与することが推奨されている26,26')。術後の代謝状態が同化期に入るpost-acute期には25-30kcal/kg/dayを目標とするのが日米欧のガイドラインからも一般的である27)。
術後のタンパク必要量も、手術の侵襲の程度により異なるが、一般的に目標値は1.2-1.5kcal/kg/日程度と考えられている。重症患者のガイドラインを参考にすると、ESPENでは1.3g/kg/dayを推奨しており、ASPEN. JSPENでは1.2-2.0g/kg/dayを推奨している。
3)術後早期経腸栄養の方法
術後は、空腸瘻などのアクセスルートより、術後24時間(もしくは36時間)以内に経腸栄養を開始する5)。
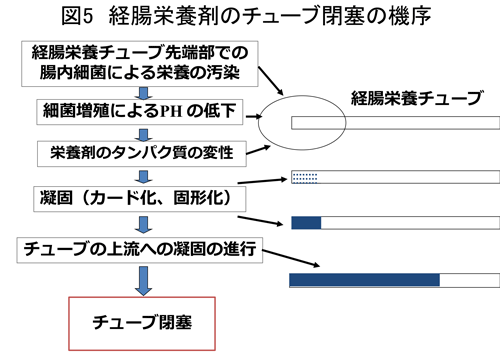
術後に使用する経腸栄養剤は一般的には標準タイプの半消化態栄養剤(もっとも一般的な1kcal/mlでたんぱく質を窒素源とした栄養剤)が用いられ、ガイドラインでも推奨されている5)。しかし、消化態栄養剤(ペプチドを窒素源とした栄養剤)や、成分栄養剤(アミノ酸を窒素源とした栄養剤)、IED、高濃度タイプ(1kcal/mlよりエネルギーの高い栄養剤)を用いることもある。著者は従来から術後早期経腸栄養には消化態栄養剤を用いている。消化態栄養剤は吸収自体の効率が良いという以外に、タンパク質を窒素源とする半消化態栄養剤はカテーテル閉塞の危険性があるが、タンパク質を窒素源としない消化態栄養剤はカード化を起こさず、カテーテル閉塞の危険もない為である(図5)。また、術後3日までの早期にはタンパク質やペプチドが強化され、高濃度(1.5kcal/ml)の経腸栄養剤を用いることで、窒素バランスを早期に回復する工夫をしている28)。
投与方法は、経腸栄養注入ポンプを用いて少量から持続投与をおこなう。10-20ml/時間の速度で開始し、目標エネルギー量に4-7日で達するように投与法を設定する5)。術後早期経腸栄養の標準的スケジュールは存在せず、各施設で独自の方法で行われているのが現状である。著者は、術翌日の朝(24時間以内)から、標準的な消化態栄養剤を用いて、注入ポンプで10ml/時間から開始し、20, 40, 60ml/時間と24時間ごとに漸増する方法をとっている(表3)。
| 術後 | 経腸栄養剤 速度(ml/時間) |
末梢輸液 (ml/日) |
|
|---|---|---|---|
| 術当日 | 0 | 1000 | |
| 1日 | 10 | 2000 | |
| 2日 | 20 | 2000 | |
| 3日 | 40 | 1500 | |
| 4日 | 60 | 1000 | |
| 5日 | 60 | 500-1000 | |
| 6日 | 60 | 500-1000 | |
この術後早期経腸栄養療法を検証したところ、スケジュール通りに行えたのは、86%で、一時的に速度を調節し、経腸栄養を続行できたのは、94%であった。静脈栄養への移行が必要だったのは4%のみであった28)。Bragaらの報告によると、その投与方法は術後12時間以内に10ml/時間、1日目20ml/時間、2日目40ml/時間、3日目60ml/時間、維持量は25kcal/kgとしており、消化器手術650例に対して術後早期経腸栄養を行ったところ、副作用もなく経過したのは70.2%で、29.3%は何らかの副作用があり、治療によって多くは経腸栄養が可能な状態に復したが、8.9%の症例では経腸栄養を断念し、静脈栄養となったと報告している29)。
急性肺障害患者を対象とした経腸栄養の臨床研究のEDENトライアルにおいて、早期から目標量のエネルギーを投与した群と最初の6日間は目標エネルギー量の25%しか投与しなかった群との比較が行われたが、両群には主要臨床的評価項目に有意差なしという結果が得られている。このことから、術後早期経腸栄養も余裕をもって目標エネルギー量に達すればよいと現時点では考えられる30)。
4)術後早期経腸栄養の合併症
術後早期経腸栄養の合併症には、①カテーテルによる機械的合併症として、前述した腸閉塞(カテーテル周囲の癒着や内ヘルニアによる)、カテーテル閉塞、カテーテルの位置異常、事故(自己)抜去、pneumatosis intestinalis、などがある。②経腸栄養による合併症として腹部膨満、腹痛、下痢などが挙げられるが、最も重症な合併症として、非閉塞性腸管膜虚血症(NOMI)が挙げられる。循環動態が安定せず、腸管への血流も低下している際に、経腸栄養が腸管内へ注入された場合、腸管の酸素消費量が増大するにもかかわらず、それに見合った腸間膜の血流量が維持できず、腸間膜血管の痙縮により、腸管虚血が起こるとされている。大量のカテコラミンや輸液、輸血を必要とする循環動態が安定しない状態での経腸栄養の開始は危険である。しかし、少量のカテコラミンの投与で循環動態が安定している場合は、慎重投与が可能といわれている31)。したがって、ショックから離脱できていない状況での経腸栄養の開始は控えるべきで、ショックから離脱後も注意深い観察の元で、少量から開始するべきと考えられる32)。
Bozzettiらは、消化器がん術後の早期経腸栄養と静脈栄養の比較を行い、術後合併症と入院期間は経腸栄養群で有意に少なく、経腸栄養の方がコストもかからないことを報告している33)。しかし、栄養療法による有害事象は下痢など、経腸栄養群で多く、約9%の症例で経腸栄養から静脈栄養への移行が余儀なくされたとしている。
2.4 術後経腸栄養への補完的静脈栄養
術後患者や重症患者の栄養管理は早期経腸栄養管理が第一選択とされてきた。術後などに経腸栄養による投与エネルギー量が上がらず、不十分の場合に、その不足分を静脈栄養で補うことを補完的静脈栄養(supplement PN)という。補完的静脈栄養を始めるタイミングに関して、術後早期の2,3日目から行うか、術後1週間以上待ってから行うかについては議論のあるところで、決着はついていない。2011年に報告されたEPaNICスタディーでは、補完的静脈栄養を48時間以内に始める早期群と8日目に始める晩期群が比較され、予想外の結果に終わった。ICU退出日数、入院日数、感染症発症率、人工呼吸器管理日数、胆汁鬱滞などに関して、晩期群が早期群に勝っていのだ34,35)。このEPaNICスタディーの結果から、早期の補完的静脈栄養のデメリットが示された。しかし一方、2013年のSPN試験では、4日目から8日目まで補完的静脈栄養を行うことで、行わない群と比較したところ、感染率は補完的静脈栄養群で低かった。比較的早期の補完的静脈栄養のメリットが示された結果となった36)。補完的静脈栄養を始めるタイミングに関して,術後早期の2〜3日目から行うか,術後1週間以上待ってから行うかについては議論のあるところで,決着はついていない.そのためガイドライン的にはICU患者において、初めの1週間までに経腸栄養投与熱量が目標エネルギー量に到達できない場合は、個々の患者の安全性と利点を判断したうえで補充的な静脈栄養をいつ始めるかを判断すべきであるとされている37)。
2.5 空腸瘻造設と術後在宅経腸栄養
手術時に空腸瘻を造設する大きなメリットは、術後の食事摂取量が少ない場合に経腸栄養で補助できることである。食道癌、胃癌や膵癌の手術時の空腸瘻造設により、術後の食事摂取量が少ない場合にも、在宅経腸経腸栄養(HEN)を行うことで、退院、在宅管理が可能となる38)。著者の経験では、高齢者やStageIV症例に対してHENを施行し在宅療養を行う方が患者の日常生活が改善する傾向がある。また、胃全摘の症例では1/5程度に、食道癌手術後ではそれより多く、退院時早期には在宅経腸栄養を行っている。
在宅経腸栄養は経口摂取の補助として施行され、日中は活動して、夜間にポンプを用いて40-80ml/時間で栄養剤を注入し、1日400-1200kcalを経腸栄養で補う。癌再発がない患者であれば、多くの場合退院後徐々に経口摂取が増加し、HENの必要がなくなる。著者らの胃癌術後の統計では、在宅栄養補助の期間は、退院後6ヵ月以内が40%、1年以内が75%となっている。一方、3年以上HENを計測する症例も10%弱認められている。
Sinoharaらは胃全摘症例連続55例に術中に空腸瘻を造設し、在宅で1日800Kcalの経腸栄養を施行した。6ヵ月後の体重減少も少なく、理想体重の平均89%が維持され、約半数は理想体重を維持できたと報告している39)。Ryanらは食道癌食道切除連続205例のうち60%は経口摂取量が少なく、必要エネルギー量の70%しか摂取できず、80%の患者は空腸瘻を置いたまま退院し、14%の患者は夜間のHENを行っく在宅管理を行うためにも有利なのである。たと報告している40)。このように、術中の空腸瘻造設は術後早期経腸栄養ばかりでなく在宅管理を行うためにも有利なのである。
Bowreyらは食道切除、胃全摘患者に空腸瘻を造設し、術後6週間にわたり夜間のHENを行ったところ、HENを行わなかった群に比較し、体重や上腕周囲長や皮下脂肪厚、筋力などが有意に上回ったと報告し、食道がん手術や胃全摘患者には空腸瘻からのHENは有効かつ安全な手段であると評価している41)。
3.ERAS(enhanced recovery after surgery)プロトコールと周術期栄養管理
3.1 ERASプロトコールとは?
北ヨーロッパを中心に始まった、早期回復のための周術期管理の包括的プロトコールである。2000年代初頭にデンマークのKehletらによって“Fast-track surgery”として術後回復強化策の概念が提唱され、2005年にFearon, Ljungqvistらによって、ERASの名称で術後回復強化策のプロトコールが包括的にまとめられた42,43)。ERASは、周術期の絶飲食の期間短縮を含め、様々な方法での術後のタンパク異化およびインスリン感受性の低下を抑制することで、術後早期回復の達成を目指している。その結果として手術の安全性向上、術後合併症の軽減、早期回復、術後在院日数の短縮、コスト低減が可能となると考えられている。当初は大腸癌に対してのプロトコールであったが、現在、その概念は幅広い疾患、術式に広げられ、適応されている。
ERASプロトコールによって外科侵襲反応が軽減し、それによって入院期間の短縮、術後合併症のリスク軽減することが、今日までの臨床研究で確認されている。現在までに、消化器癌では大腸がん、胃がん、肝臓手術、膵臓手術、肥満手術など、また他の領域では整形外科、婦人科手術などでERASの有用性が確認されている。
ERASプロトコールの内容(表4)は以下のようなもので構成されている44)。
- 手術後の回復を促進し早期に通常の状態に戻すこと
- 手術の侵襲を最小限にする術式の選択
- 早期経口摂取の促進と静脈栄養の早期中止
- 早期離床
- 十分な疼痛管理 など
ERASプロトコール |
|---|
|
3.2 周術期栄養管理に関するERAS
ERASプロトコールの中で、栄養管理に関する項目は以下のようである。
- 術前の絶食期間を避ける
- 術後経口栄養をできるだけ早く開始する
- 手術ストレスに関連した異化亢進や消化管機能障害を起す要因を排除する
術前絶食の短縮に関しては、術前の深夜からの絶食は必要がないことが強調されている。誤嚥のリスクのない術前患者は、麻酔2時間前までclear fluidを飲むことは問題なく、固形食は麻酔の6時間前までの摂取が許可される。とくに、ESPENでは、メジャーな手術を受ける患者に手術前夜(800ml)と手術2時前まで(400ml)に12.5%の炭水化物飲料の摂取を推奨している。術前の飢餓状態に伴う代謝ストレスを軽減し、術後のインスリン抵抗性を減少させると考えられている。
早期経口栄養に関しては、一般的には、術後のONSまたは食事の経口摂取は手術の直後から可能であるとされている。特に下部消化管手術においては早期経口栄養が推奨される。ESPENでは大腸切除患者の大半は手術の数時間後からclear fluidを含めた経口摂取が可能であるとしている。多くのERASを実践している病院では、術後4時間でONSの経口摂取が開始され、術当日もしくは術後1日目の朝から常食が出されている。
ERAS Societyから出された胃切除術および膵頭十二指腸切除術のガイドラインではいずれも術後には制限のない普通食の早期経口栄養が推奨されている45,46)。ただし、食事摂取に耐えられない例もあること、そのような例には慎重に食事を進める事は明記されている。経口摂取は、手術の種類や患者の状態により個別に配慮される必要があることは忘れてはならない。
4.術後経口摂取と術後食
4.1 今までの本邦術後食
術後食、とくに消化器手術後の術後食は、「手術後、消化管の運動が回復したら、はじめは流動食から徐々に普通の食事に戻していく。普通の食事に戻すのにいくつかのステップアップがある。」という考え方は、本邦をはじめ世界の国々の共通であった。本邦では、流動食の重湯から始まり、徐々に米の粥の水分が減り、お米の割合が高くなっていくという、きめ細やかな術後食を従来から踏襲してきた。重湯、3分、5分、7分、全粥、常食の6ステップがもっとも一般的である(図6)。この起源に関しての定説はないが、腸チフスの回復期の治療食のシステムを、そのまま術後食に応用し、現在の術後食の体系が形成という説がある。胃切除を例にとると、排ガスがあるか、腸蠕動の回復する術後5~7日ぐらいから、流動食を開始し、1日ごともしくは2日ごとに、3分粥、5分粥と段階的に食事のアップを図るのが習わしであった。術後食は世界的に見ても、もっともエビデンスに乏しく、科学的でない病院食で、医師や管理栄養士も研究対象として取り上げてこなかった。

4.2 術後食改革
入院期間の短縮の必要性や、クリニカルパスの普及、著者による世界の術後食研究などが契機となり、術後食の見直しの機運が高まっていたところに、欧米からのERASが後押しをするかたちとなって、術後食の改革がが行われてきている。早期経口栄養と、術後食のステップ数を減らすなどの試みである。ERASを実践するスウェーデンの病院では、結腸切除術後1日目から、量を少なくした常食を提供し、段階食はない(図7)。

ERASプロトコールに従い、術後1日目の朝から小盛りの常食が出される。
2日目には量が増えるだけである。
アジアの国々でも同様の試みが行われており、香港大学病院でも結腸術後1日目から、流動食、2日目に粥食、3日目には常食を与えている(図8)。

食事自体を変化させ、術後に食べやすくする試みも行われてきた。酵素を用いて、食物を形を保ったまま軟化させる技術を用いた軟化食(あいーと®)は、嚥下障害患者にも使用されているが、それを胃切除後、大腸切除後に早期から摂食するプロトコールも試みられてきた(図9)。
このように、現在、術後食は以前のシステムから解放され、数々の試みが行われている。
最後に
現在、ERASの普及とともに欧米では、今まで空腸瘻を造設していた膵頭十二指腸切除に対して、空腸瘻を作らなくなっている施設がある。その理由は経口栄養を早期に始めるので、必要がないというものである。そして、膵液瘻や食事が進まない場合には、その時TPNを行えばよいという、一見乱暴ともいえる栄養管理がまかり通ってきている。これはある意味、術後栄養管理の後退ともとれる状況である。今後、本邦でも術後栄養管理は経口栄養が主体となっていく考えられる。将来的には、術中の空腸瘻の造設は、術後早期経腸栄養という目的というより、術後の食事摂取量が少ない患者に対しての補完的な経腸栄養、そして在宅を考慮に入れた長期にわたる栄養管理を行う目的としての存在価値が重要となってくると思われる。
文献
- Lassen K, Coolsen MM, Slim K, Carli F, de Aguilar-Nascimento JE, Schäfer M, Parks RW, Fearon KC, Lobo DN, Demartines N, Braga M, Ljungqvist O, Dejong CH; ERAS® Society.; European Society for Clinical Nutrition and Metabolism.; International Association for Surgical Metabolism and Nutrition: Guidelines for perioperative care for pancreaticoduodenectomy: Enhanced Recovery After Surgery (ERAS®) Society recommendations. Clin Nutr.31:817-30, 2012
- Mortensen K, Nilsson M, Slim K, Schäfer M, Mariette C, Braga M, Carli F, Demartines N, Griffin SM, Lassen K; Enhanced Recovery After Surgery (ERAS®) Group: Consensus guidelines for enhanced recovery after gastrectomy: Enhanced Recove371ry After Surgery (ERAS®) Society recommendations. Br J Surg.101:1209-29, 2014
- Kondrup J, Rasmussen HH, Hamberg O, et al:Nutritional risk screening (NRS 2002): a new method based on an analysis of controlledc linical trials. Clinical Nutrition 22:321-336, 2003
- Weimann A, Braga M, Carli F,Higashiguchi T, Hübner M, Klek S, Laviano A, Ljungqvist O, Lobo DN, Martindale RG, Waitzberg D, Bischoff FC, Singer P: ESPEN practical guideline: Clinical nutrition in surgery. Clin Nutri 40: 4745-4761, 2021
- 日本静脈経腸栄養学会編集:周術期、静脈経腸栄養ガイドライン、p-222-229, 照林社、東京、2013
- Cerantola Y, Hübner M, Grass F, Demartines N, Schäfer M: Immunonutrition in gastrointestinal surgery. British J Surg 98:37-48, 2011
- Waitzberg DL, Saito H, Plank LD, Jamieson GG, Jagannath P, Hwang TL, Mijares JM, Bihari D: Postsurgical infections are reduced with specialized nutrition support. World J Surg 30: 1592-1604, 2006
- Weimann A, Braga M, Carli F, et al: ESPEN guideline: Clinical nutrition in surgery. Clin Nutr 2017; 36: 623-650
- Heyland DK, Dhaliwal R, Drover JW, Gramlich L, Dodek P; Canadian Critical Care Clinical Practice Guidelines Committee: Canadian clinical practice guideline for nutrition support for mechanically ventilated , critically ill adult patients. JPEN 27: 355-373, 2003
- Kanazawa H, Nagino M, Kamiya S, Komatsu S, Mayumi T, Takagi K, Asahara T, Nomoto K, Tanaka R, Nimura Y: Synbiotics reduce postoperative infectious complications: a randomized controlled trial in biliary cancer patients undergoing hepatectomy. Langenbecks Arch Surg. 390:104-13, 2005
- Sugawara G1, Nagino M, Nishio H, Ebata T, Takagi K, Asahara T, Nomoto K, Nimura Y: Perioperative synbiotic treatment to prevent postoperative infectious complications in biliary cancer surgery: a randomized controlled trial. Ann Surg. 244:706-14, 2006
- Yokoyama Y1, Nishigaki E, Abe T, Fukaya M, Asahara T, Nomoto K, Nagino M: Randomized clinical trial of the effect of perioperative synbiotics versus no synbiotics on bacterial translocation after oesophagectomy. Br J Surg.101:189-99, 2014
- 筧慎吾、若林秀隆:プレハビリテーション介入による術前環境の適正化、外科と代謝 55:170-174, 2021
- Gillis C, Ljungqvist O, Carli F: Prehabilitation, enhanced recovery after surgery, or both? A narrative review, British Journal of Anaesthesia 128: 434-448, 2022
- Moore FA, Feliciano DV, Andrassy RJ, McArdle AH, Booth FV, Morgenstein-Wagner TB, Kellum JM Jr, Welling RE, Moore EE: Early enteral feeding, compared with parenteral, reduces postoperative septic complications. The results of a meta-analysis. Ann Surg. 216: 172-83, 1992
- Compher C, et al: Guidelines for the provision of nutrition support therapy in the critically ill patients: ASPEN, JPEN46:12-41, 2022
- 丸山道生:手術的空腸瘻造設用カテーテルキットの開発と臨床応用、手術59: 1331-1334, 2005
- 丸山道生:空腸瘻、丸山道生編、経腸栄養バイブル、p134-137、日本医事新報社、東京、2007
- 丸山道生:周術期の経腸栄養管理、消化器外科37:1927-1938,2014
- Sarr MG: Appropriate use, complications and advantages demonstrated in 500 consecutive needle catheter jejunostomies. British Journal of Surgery 86: 557-561, 1999
- Myers JG, Page CP, Stewart RM, Schwesinger WH, Sirinek KR, Aust JB: Complications of needle catheter jejunostomy in 2022 consecutive applications. American Journal of Surgery 170: 547-551, 1995
- Marik PE, Zaloga GP: Early enteral nutrition in critically ill patients: a systematic review. Crit Care Med 29: 2264-2270, 2001
- Peter JV, Moran JL, Phillips-Hughes J: A metaanalysis of treatment outcomes of early enteral versus parenteral nutrition in hospitalized patients. Crit Care Med 33: 213-220, 2005
- Harvey SE, Parrott F, Harrison DA, Bear DE, Segaran E, Beale R, Bellingan G, Leonard R, Mythen MG, Rowan KM; CALORIES Trial Investigators.:Trial of the route of early nutritional support in critically ill adults. N Engl J Med 371: 1673-84, 2014
- Singer P, Berger MM, Van den Berghe G, et al: ESPEN Guidelines on Parenteral Nutrition: Intensive care. Clinical Nutrition 28: 387–400, 2009
- Singer P, Blaser AR, BergerMM, et al: SPEN guideline on clinical nutrition in the intensive care unit. AR, BergerMM, et al:ESPEN practical and partially revised guideline: CliniClinical Nutrition 38: 48-79, 2019
26‘.Singer P, Blaser AR, BergerMM, et al:ESPEN practical and partially revised guideline: Clinical nutrition in the intensive care unit. Clinical Nutrition 42: 1671-1689, 2023 - McClave SA, Taylor BE, Martindale RG, et al: Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient, JPEN 40: 159-211, 2016
- Maruyama MJ: Postoperative early enteral nutrition using two type enteral formula, high energy/high protein type and common type. Clin Nutr 32(Suppl.1): S98, 2013
- Braga M, Gianotti L, Gentilini O, Liotta S, Di Carlo V.: Feeding the gut early after digestive surgery: results of a nine year experience. Clinical Nutrition 21: 59-65, 2002
- National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network., Rice TW, Wheeler AP, Thompson BT, Steingrub J, Hite RD, Moss M, Morris A, Dong N, Rock P: Initial trophic vs full enteral feeding in patients with acute lung injury: the EDEN randomized trial. JAMA. 307:795-803, 2012
- 巽博臣、升田好樹、後藤京子:経腸栄養開始の条件;循環の安定性の評価、腸管機能評価、合併症対策、日本静脈経腸栄養学会雑誌30:659-663、2015
- 小谷穣司、山田勇、平井康富、藤崎宣友、上田敬博、白井邦博:重症患者栄養管理ガイドラインのオーバービュー、外科と代謝・栄養50:97-109、2016
- Bozzetti F, Braga M, Gianotti L, Gavazzi C, Mariani L: Postoperative enteral versus parenteral nutrition in malnourished patients with gastrointestinal cancer: a randomized multicentre trial. Lancet 358: 1487-1492, 2001
- Casaer MP, Wilmer A, Hermans G, Wouters PJ, Mesotten D, Van den Berghe G:Role of disease and macronutrient dose in the randomized controlled EPaNIC trial: a post hoc analysis. Am J Respir Crit Care Med. 187:247-55, 2013
- Casaer MP, Mesotten D, Hermans G, Wouters PJ, Schetz M, Meyfroidt G, Van Cromphaut S, Ingels C, Meersseman P, Muller J, Vlasselaers D, Debaveye Y, Desmet L, Dubois J, Van Assche A, Vanderheyden S, Wilmer A, Van den Berghe G: Early versus late parenteral nutrition in critically ill adults. N Engl J Med. 365:506-17, 2011
- Heidegger CP, Berger MM, Graf S, Zingg W, Darmon P, Costanza MC, Thibault R, Pichard C: Optimisation of energy provision with supplemental parenteral nutrition in critically ill patients: a randomised controlled clinical trial. Lancet.381:385-93, 2013
- Singer P, Blaser AR, Berger MM, et al: ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 2019; 38: 48-79
- 丸山道生:上部消化管癌患者の外来化学療法の安全性を維持するための在宅経腸栄養療法、外科と代謝・栄養、46:113-119、2012
- Shinohara T, Fujita T, Suzuki Y, Sano Y, Kashiwagi H, Yanaga K:Interim results of nutritional support through a button-type jejunostomy after total gastrectomy. The American Surgeon 75: 148-151, 2009
- Ryan AM, Rowley SP, Healy LA, Flood PM, Ravi N, Reynolds JV.: Post-oesophagectomy early enteral nutrition via a needle catheter jejunostomy: 8-year experience at a specialist unit. Clinical Nutrition 25: 386-393, 2006
- Bowrey DJ, Baker M, Halliday V, Thomas AL, Pulikottil-Jacob R, Smith K, Morris T, Ring A:A randomised controlled trial of six weeks of home enteral nutrition versus standard care after oesophagectomy or total gastrectomy for cancer: report on a pilot and feasibility study. Trials 16:531, 2015
- Kehlet H., Wilmore DW: Multimodal strategies to improve surgical outcome. Am J Surg 183: 630–641, 2002
- Fearon KCH, Ljungqvist O, Von Meyenfeldt M, et al: Enhanced recovery after surgery: a consensus review of clinical care for patients undergoing colonic resection. Clin Nutr 24:466–77, 2005
- Fearon KCH, et al: Enhanced recovery after surgery: A consensus revciew of clinical care for patients undergoing colonic resection. Clin Nutr 24: 466-477, 2004
- Lassen K, et al: Guidelines for perioperative care for pancreaticoduodenectomy: Enhanced Recovery After Surgery (ERAS) Society recommendations. Clin Nutr 31: 817-830, 2012
- Mortensen K, et al: Consensus guidelines for enhanced recovery after gastrectomy, Enhanced Recovery After Surgery (ERAS) Society recommendation. British J Surg 101: 1209-1229, 2014



