- PDNレクチャーとは?
- Chapter1 PEG
- Chapter2 経腸栄養
- Chapter3 静脈栄養
- 1.末梢静脈栄養法(PPN)
- 1.1 PPNの特徴と適応
- 1.2 PPN製剤の種類と適応
- 1.3 PPNカテーテルの種類
- 1.4 PPNカテーテルの留置と管理
- 2.中心静脈栄養法(TPN)
- 2.1 TPNの特徴と適応
- 2.2 CVカテーテルの種類
- 2.3 CVカテーテル留置法
- 2.4 皮下埋め込み式CVポートと
その留置法 - 2.5 PICCとその留置法
- 2.6 エコーガイド下での
CVカテーテル留置法 - 2.7 TPN時の使用機材
- 2.8 TPN基本液とキット製剤の種類と特徴
- 2.9 アミノ酸製剤の種類と特徴
- 2.10 脂肪乳剤の種類と特徴
- 2.11 TPN用ビタミン製剤の種類と特徴
- 2.12 微量元素製剤の種類と特徴
- 2.13 TPNの実際の投与方法と管理
- 2.14 TPNの合併症
- 2.15 特殊病態下のTPN
- 2.16 小児のTPN
- 2.17 TPN輸液の調製方法
- 2.18 HPN(在宅経静脈栄養)
- Chapter4 摂食・嚥下リハビリ
- PDNレクチャーご利用にあたって




2022年5月18日改定
1.TPNの定義と呼称
TPNは、total parenteral nutritionの略であり、日本語に直訳すると完全腸外栄養(腸以外の栄養)となり、通常は完全静脈栄養となる。すなわち、完全な栄養を腸以外から(静脈的に)行う手法である。すなわち、腸管を使用しないで、生命活動や成長に必要な5大栄養素(炭水化物、蛋白、アミノ酸、脂質、ミネラル、ビタミン)すべてを静脈から供給することを指す。
TPNという用語は、その開発者として有名なDudrickが、1968年の論文のタイトルで用いている1)。
一方、TPN開発のもう一人の立役者で、安全な脂肪乳剤の開発者として知られるWretlindは、complete parenteral nutritionと呼んでいる2)。またparenteral alimentation、intravenous nutrition、intravenous feedingなどの呼称もこれまで用いられてきている。現在わが国では、前述の完全静脈栄養よりも、中心静脈栄養、高カロリー輸液、あるいはそのままTPNと呼ばれることが多いように思われる。
一方、臨床現場で時に耳にする IVHという呼称があるが、これはintravenous hyperalimentationの略語である。1970年のDudrickらの論文で使用されているが3)、hyperは過剰を示唆する用語である。当時は、侵襲時には意図して通常の必要量より多く投与するという意味合でhyperalimentationという言葉が使用されたようである。しかし、最近わかってきたことは、TPNの弊害の主たる要因がこのhyperalimentationだということである(後述)。近年、推奨栄養投与量は以前よりも低く設定されることが多く、過剰投与は過少投与よりも有害であるとの認識が浸透してきている。文字通り“過剰”を意味するhyperalimentationという用語は一般的に使用すべきではなく、現在はTPNという呼称を使用することが望ましいと考えられている。事実、IVH と言う用語はもはや世界的には使用されておらず、PubMedを検索しても、1990年以降intravenous hyperalimentationがタイトルに含まれる論文はそのほとんどが日本人のものである。さらに中心静脈カテーテルを挿入することを“IVHを入れる”などと明らかな誤用表現がなされることもあり、正確な用語を用いるべく、指導的立場にある者は特に注意する必要がある。
TPNに対して末梢から行う静脈栄養はPPNと呼ばれ、特に我が国ではTPNの対局に位置づけられ区別されている。しかし、厳密には末梢からでもcomplete parenteral nutritionが不可能というわけではなく、Wretlindらの脂肪を中心とした処方はもともとこれを 念頭に開発されたものである。逆に中心静脈から補助的な静脈栄養を行うこともあるので、TPNに対してpartial parenteral nutritionということでPPN、投与部位の対比としてはperipheralに対してcentral parenteral nutritionとした方が厳密かもしれない。現在の海外のガイドラインでは、いわゆるTPN、PPNは一括して静脈栄養(PN:parenteral nutrition)として扱われ、厳密に区別されていない。一方、JSPENのガイドラインでは、60%以上のエネルギーを投与する場合をTPN、それ以下の場合をSPN(supplemental parenteral nutrition:補助的静脈栄養)と定義している。
2.輸液とTPNの歴史
輸液の起源は、17世紀になって、William Harveyが「血液の循環の原理」(1628年)を発表したことが端緒とされるが、最初の輸液はイギリスの生理学者、天文学者、またSt Paul大聖堂の建築に関わった建築家でもあるSir Christopher Wrenが1658年にガチョウの羽と豚の膀胱を用いてワインやaleをイヌの血管内に投与したのが始まりとされている。電解質輸液は、1832年にイギリスのLattaが、塩化ナトリウム0.5%と炭酸水素ナトリウム0.2%を含む製剤をコレラの治療に投与したのが始まりで、その後、1883年にRingerが塩化ナトリウムの他にカルシウムやカリウムを配合したリンゲル液を開発した。
栄養輸液に関しては、1911年にKaushが栄養目的のブドウ糖静脈内投与を行ない、1930年代にはブドウ糖の輸液が普及していった。しかし、TPNが完遂できるためには、不純物のない組成が一定したアミノ酸液や安全に投与できる脂肪製剤が必須であった。当初はタンパク質を酵素で加水分解したアミノ酸液を使用していたが、ペプチドが含まれることやアミノ酸組成が一定しないことなど問題点が多かった。しかし、1950年ころから、個々の結晶アミノ酸の精製が可能となり、本格的な栄養輸液の検討が行なわれ、種々のアミノ酸輸液製剤の開発がなされていった(日本の技術が大きな役割を果たした)。1965年には、スウェーデンのWretlindらによってダイズ油を用いた脂肪乳剤が開発され、こうして1960年代後半には、3大栄養素の輸液製剤がそろうこととなり、完全静脈栄養を行う環境が整っていった。
完全静脈栄養で十分なエネルギーを投与するためには、高濃度糖液の静脈内投与が必要である。例えば1,600kcalをブドウ糖で投与するためには20%液2,000mlを要する。しかし、20%ブドウ糖液は浸透圧が高く(5%が等張)静脈炎が起るために末梢静脈から投与できなかった。Dudrickらは高濃度の糖やアミノ酸液を、中心静脈から投与することでこの問題を解決した。そして1967年、静脈栄養のみでビーグル犬の仔犬6頭を72~256日飼育し、正常に発育することを証明した。彼らはこの経験をもとに、高度の栄養障害を有し、消化管に問題がある消化器外科患者6症例に対して、外頚静脈から挿入したカテーテルを用いて、静脈栄養のみで15~48日間管理した。この時の処方は、20%デキストロース、5%のフィブリン水解物、電解質、ビタミン、微量ミネラルであったとされる(表1)。さらに、1967年の6月には、near-total small bowel atresiaの新生児に対して95%以上の小腸切除を行い、十二指腸と3cm残存した回腸とを吻合し、中心静脈から完全静脈栄養を22ヵ月間行い、最終的には死亡したものの、体重を4ポンドから18.5ポンドに成長させることに成功した。しかしこの間、頸静脈から6回、伏在静脈から1回、橈側皮静脈1回、鎖骨下静脈から8回のカテーテル挿入を要したとのことであり、静脈経路確保の難しさを物語っている。
| Dudrick | Wretlind | |
|---|---|---|
Daily dose (L) |
2.4 - 4.5 | 2.3 |
Energy (kcal/L) |
1000 | 924 |
Amino Acids (g/L) |
37.5 | 30 |
Glucose (g/L) |
212 | 98* |
Fat (g/L) |
- | 49** |
Energy (kcal/day) |
2000 - 4000 | 2125 |
** 2.6 g of phsphatide
ほぼ時を同じくしてWretlindらは、それまで副作用が多かった脂肪乳剤に対して、ダイズ油と卵黄レシチンを乳化剤とした安全な製剤、Intralipidを開発した(1965年)。これは、BEEのエネルギー量全てを長期間脂肪で投与することを目標に開発がすすめられたもので、犬を用いて28日間にわたり、BEEに相当する9g/kg/dayを投与することに成功した。Wretlindらは、これをもとに、エネルギーの約50%を脂肪で投与する静脈栄養のシステムを開発し(表1)、1968~69年にわたり7ヵ月以上、女性患者を静脈栄養だけで管理することができた。
このように、米国DudrickらのTPNは非蛋白カロリーをすべてブドウ糖で投与するものでGlucose system(開発当時米国では脂肪乳剤がFDAによって許可されていなかった)、これに対して脂肪中心に投与するスウェーデンWretlindらのものをlipid systemといわれた2, 4)。
3.TPNの特徴
炭水化物、蛋白、脂肪、ミネラル、ビタミンという生存に必要な五大栄養素すべてを経静脈的に供給する。全く経口摂取や経腸栄養ができなくても長期間の生存や成長が可能である。炭水化物は主にブドウ糖液、蛋白はアミノ酸液、脂肪は脂肪乳剤というかたちで投与される。今やこの方法を用いることで、全く経口摂取ができなくとも長期生存が可能であり、さらに妊娠や出産を経験する者もいる。1日の水分投与量が過剰にならずに必要量を満たす為には、高濃度の糖やアミノ酸を静脈内に投与することが要求されるが、高濃度の糖液やアミノ酸液は浸透圧が高く、末梢静脈から投与すると痛みや静脈炎を惹起するため、血液の流量が多く投与された溶液がすぐに希釈される中心静脈から通常投与する。
Wretlindらの脂肪を多用する処方は(NPCの約50%を脂肪で投与)、開発の歴史的背景からヨーロッパで広く用いられており、末梢からの投与でも比較的高いカロリーを投与することが可能ではある。しかし、末梢からの投与では、長期的に静脈炎の発症は避けられない。安定的な静脈経路確保という面も含めて、長期には中心静脈からの投与が行なわれる。近年末梢から中心静脈にカテーテルを挿入するPICCが、簡便で合併症が少ないカテーテルとして注目され、我が国でもその使用頻度が増している。
4.TPNの適応
栄養管理は、“If the gut works, use it.”と言われているように、消化管を使用して行うことが大原則である。したがって、消化管機能が保たれている場合は、経腸的な栄養を行うことが基本であり、TPNは適応すべきではない。例えば脳出血や脳梗塞、筋萎縮性側索硬化症などの神経•脳疾患による経口摂取障害などはTPNを行うべきでない疾患の代表であろう。また周術期において栄養状態が良好な患者へのTPN(特に短期投与)、術後のルーチンのTPNは術後合併症をむしろ増加させるとの報告があり望ましくない。後述するように、腸管は生体防御に関わるさまざまな重要な役割をはたしており、腸管を利用することが生体防御上有用であることがわかっている。
しかし、さまざまな状況下で消化管が使用できない(使用すべきでない)、あるいは使用できても不十分な場合があり、このような場合にTPNを含めた静脈栄養が適応となる。具体的には短腸症候群の急性期や消化管閉塞(イレウス)などにおけるTPNの絶対的適応と、経腸栄養は可能でも十分量を満たせない相対的、補完的適応があり、後者では末梢ルート(PPN)が選択される場合もある(図1)(表2)。
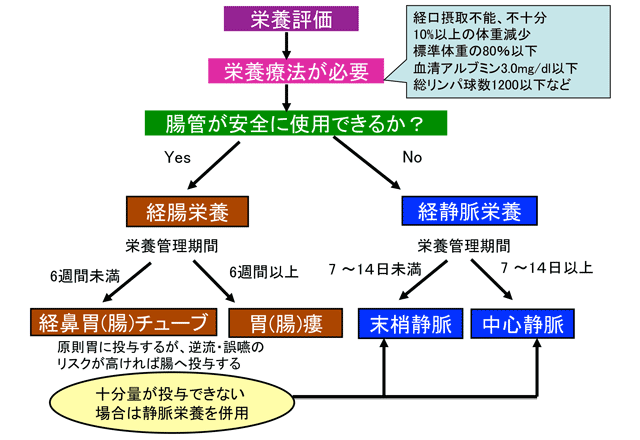
絶対的適応:消化管の使用が不可能あるいはすべきでない場合
|
相対的適応 経口•経腸栄養で十分量を投与できない場合
|
消化管閉塞や消化管手術後の縫合不全、消化管瘻などは静脈栄養の絶対的適応となることも多いが、食道狭窄や幽門狭窄があっても狭窄部を越えて栄養チューブが挿入可能な場合、あるいは縫合不全や消化管瘻でもそれより肛門側の腸管に栄養が投与できる場合は、経腸栄養がよい適応となることがある。また、従来は静脈栄養が望ましいと考えられていた(重症)急性膵炎でも、エビデンスに基づくと、経腸栄養の選択が推奨されているので4)、これらのことも考慮しつつTPNの適応を検討する。そして、経腸栄養が可能でも十分な量が投与できない期間が一定以上つづく場合、躊躇なく静脈栄養を併用して必要かつ十分な栄養投与を行う。逆に、TPN施行中に少しでも経腸的栄養投与が可能となった場合は、少量でよいので、遅滞なく経腸栄養を開始することも肝要である。10%でも腸管へ栄養を投与すると、腸管粘膜萎縮が抑制されることが、ラットの動物実験では示されている5)。
5.TPNの長所と短所
TPNの長所としては、当然のことながら、消化管に頼らず十分な栄養投与が可能であることがまず第一に挙げられる。また、投与エネルギーや栄養成分を正確・確実に体内に入れることができ、水分の出納も厳密に管理することができる。さらに中心静脈ラインが確保されているので、重症例への薬剤投与をはじめとした緊急時対応が容易であるという側面もある。
一方、気胸に代表されるカテーテル挿入時の種々の合併症や、カテーテル感染、血栓形成など、カテーテルに関連する合併症が少なくないこと、高血糖をきたしやすいこと、長期的には脂肪肝などの代謝性合併症が起こりやすいこと、コストが高いことなどは短所である。
また、腸管は消化吸収以外にも管内の細菌や毒素が体内へ侵入する(bacterialtranslocation)を防ぐバリアー臓器としての役割があり、さらに腸管が体内で最大級の免疫組織であることも忘れてはならず、このような腸管を使用しない静脈栄養を続けると、生体防御に不利に作用することが様々な研究で明らかにされてきた。静脈栄養と経腸栄養を比較した多くの臨床研究で、前者で合併症、特に肺炎や腹腔内膿瘍などの感染性合併症が有意に多いことが明らかとなっている6)。
TPNの開発以降、これが爆発的に普及し、一部の濫用ともいえる状況の反省から、上記のエビデンス等に基づき、TPNの弊害が強調されるようになった。しかし最近、これらTPNの負の側面の多くが、ルートそのものよりもむしろ過剰投与や高血糖に関連することが指摘されるようになった7)。ICU患者で経腸栄養と静脈栄養を比較した最近のmeta-analysisでは、静脈栄養でエネルギー投与量が多い場合は、有意に感染性合併症が多くなったが、両群でエネルギー投与量が同等の場合は、感染性合併症発生率に差が認められていない8)。一般に病状が重篤になるほど腸管麻痺などが進行し、経腸栄養は十分に入らない。一方TPNは長所として“栄養素を確実に体内に入れることができる”ので、そのことがかえって過剰投与や高血糖を招く危険を増大させるのである。特に炎症が高度の時は、体タンパクの崩壊などによる内因性のエネルギーが多く供給されているので、特に注意が必要である。したがって、これらを十分念頭において、適切にTPN行ってゆくことが望まれる。
6.おわりに
TPNは優れた栄養法である。適応を良く見きわめ、適切な方法で十分に活用して行く必要がある。
文献
- Dudrick SJ, Wilmore DW, Vars HM, Rhoads JE: Long-term total parenteral nutrition with growth, development, and positive nitrogen balance. Surgery 1968, 64:134-142.
- renteral nutrition. The Surgi Wretlind A: Pacal clinics of North America 1978, 58:1055-1070.
- Dudrick SJ: Intravenous hyperalimentation. Surgery 1970, 68:726-727.
- Yao H, He C, Deng L, Liao G: Enteral versus parenteral nutrition in critically ill patients with severe pancreatitis: a meta-analysis. Eur J Clin Nutr 2018, 72:66-68.
- Omura K, Hirano K, Kanehira E, Kaito K, Tamura M, Nishida S, Kawakami K, Watanabe Y: Small amount of low-residue diet with parenteral nutrition can prevent decreases in intestinal mucosal integrity. Ann Surg 2000, 231:112-118.
- 福島亮治: 生体における腸管免疫の重要性. 臨床外科 2009, 64:1333-1338.
- Berger MM, Pichard C: Parenteral nutrition in the ICU: Lessons learned over the past few years. Nutrition 2019, 59:188-194.
- Elke G, van Zanten AR, Lemieux M, et al: Enteral versus parenteral nutrition in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials. Crit Care 2016, 20:117.