- PDNレクチャーとは?
- Chapter1 PEG
- Chapter2 経腸栄養
- Chapter3 静脈栄養
- 1.末梢静脈栄養法(PPN)
- 1.1 PPNの特徴と適応
- 1.2 PPN製剤の種類と適応
- 1.3 PPNカテーテルの種類
- 1.4 PPNカテーテルの留置と管理
- 2.中心静脈栄養法(TPN)
- 2.1 TPNの特徴と適応
- 2.2 CVカテーテルの種類
- 2.3 CVカテーテル留置法
- 2.4 皮下埋め込み式CVポートと
その留置法 - 2.5 PICCとその留置法
- 2.6 エコーガイド下での
CVカテーテル留置法 - 2.7 TPN時の使用機材
- 2.8 TPN基本液とキット製剤の種類と特徴
- 2.9 アミノ酸製剤の種類と特徴
- 2.10 脂肪乳剤の種類と特徴
- 2.11 TPN用ビタミン製剤の種類と特徴
- 2.12 微量元素製剤の種類と特徴
- 2.13 TPNの実際の投与方法と管理
- 2.14 TPNの合併症
- 2.15 特殊病態下のTPN
- 2.16 小児のTPN
- 2.17 TPN輸液の調製方法
- 2.18 HPN(在宅経静脈栄養)
- Chapter4 摂食・嚥下リハビリ
- PDNレクチャーご利用にあたって




2023年4月10日版
1.はじめに
微量元素の定義、各微量元素の特徴(生理作用、欠乏症、過剰症など)などは、「PDNレクチャーChapter2 4.2 微量元素製剤」、あるいは各成書を参考にしていただきこの場では割愛することとし、現在、本邦で発売されている高カロリー輸液用微量元素製剤の特徴などを記載する。
2.現在市販されている高カロリー輸液用微量元素製剤
静脈栄養における微量元素の推奨量などは、米国静脈経腸栄養学会(A.S.P.E.N.)1)の値を示した(表1)。

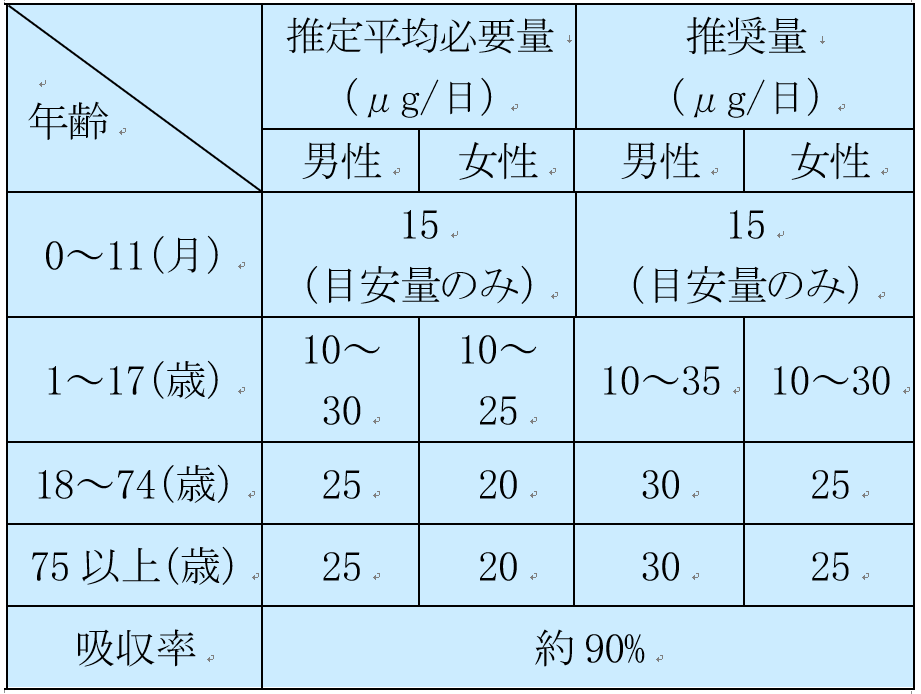
なお、厚生労働省から出されている日本人の食事摂取基準(2020年度版)2)の情報も参考値として示した(表2~7)。
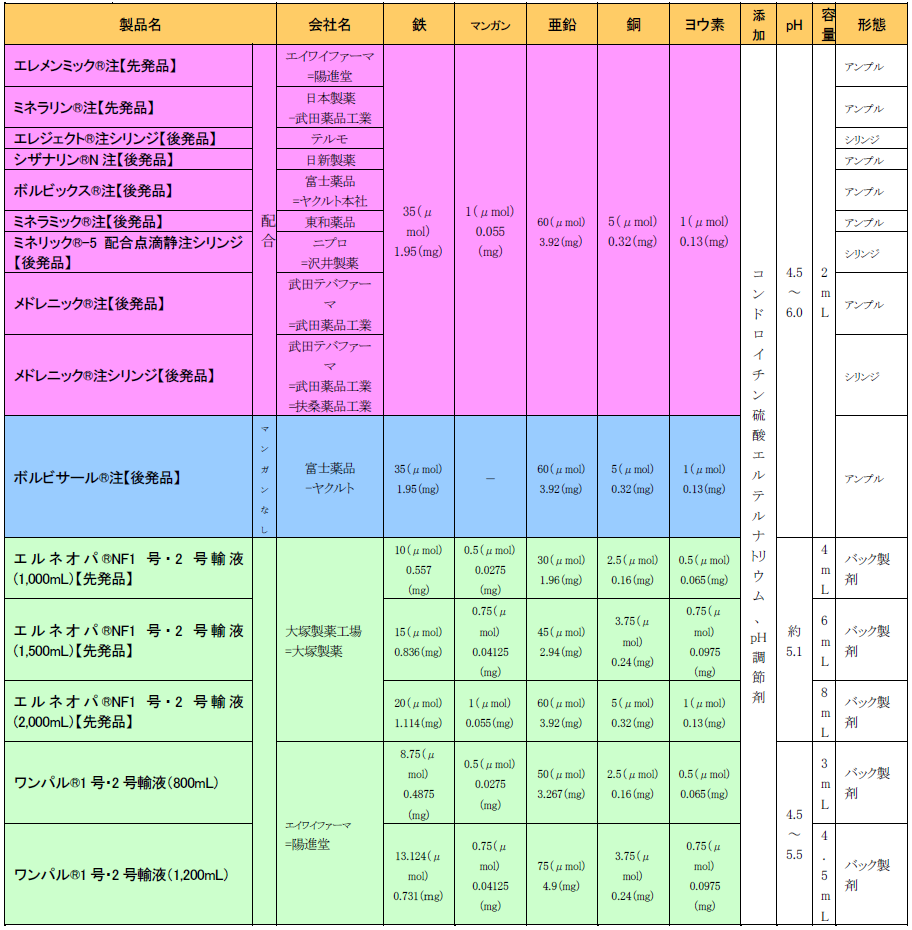
鉄(Fe)、マンガン(Mn)、亜鉛(Zn)、銅(Cu)、ヨウ素(I)の5種類の微量元素が含まれている製剤(以下、マンガン含有製剤)と、マンガンを含有しない鉄、亜鉛、銅、ヨウ素の4種類の微量元素が含まれている製剤(以下、マンガン非含有製剤)があり、アンプル製剤とシリンジ製剤の2種類がある(表8)。また、2019年にセレン(Se)製剤(アセレンド®注 100μg)が発売された。
鉄の食事摂取基準
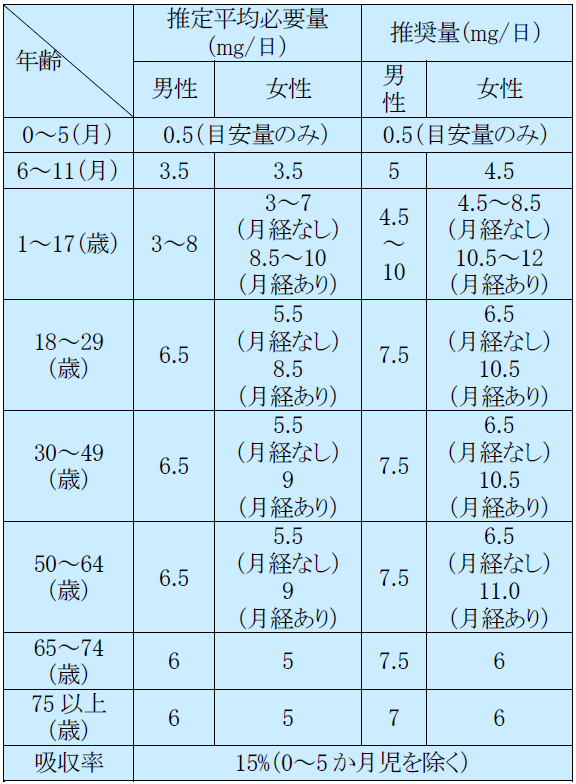
なお、現在市販されているTPN基本液及びTPNキット製剤には亜鉛が含有されており、エルネオパ®NF1号・2号輸液、ワンパル®1号・2号輸液にはマンガンを含む5種類の微量元素が含まれている。
近年、静脈栄養における各種栄養素の1日必要量に関する見直しやガイドラインの改訂が行われていて、微量元素に関しては、米国のA.S.P.E.N.(American Society for Parenteral and Enteral Nutrition(米国静脈経腸栄養学会))のガイドラインや欧州のESPEN(European Society for Clinical Nutrition and Metabolism(欧州臨床栄養代謝学会))のガイドラインが改訂されている。
このような背景に鑑み、微量元素処方についてESPENガイドラインを参考にしたエルネオパ®NF1号・2号輸液が上市され、鉄の処方が改良されている。
ワンパル®は、ESPENガイドラインに基づき鉄を減量した製剤で、既承認のTPN製剤は2,000mLの投与で1日に必要とされる熱量、アミノ酸、ビタミン及び微量元素を補給可能な設計とされているが、既承認のTPN製剤よりも少ない投与液量で1日の所要栄養量を補給可能な設計となっている。
3.微量元素の主たる排泄経路
- ①鉄: 過剰な鉄は腸管上皮細胞内にフェリチンとして貯蔵され、腸管上皮細胞の剥離に伴って消化管内に排泄される2)。 また、殆どは体内ヘモグロビンの合成に利用されるが,一部は尿中へ排泄されると考えられる、との報告もある3)。
- ②亜鉛:未吸収の亜鉛や腸管粘膜の脱落、膵液の分泌などに伴う体内亜鉛(内因性亜鉛)の糞便中への排泄によって主に行われる。亜鉛の尿中排泄量は少なく、摂取量にかかわらずほぼ一定である2)。
- ③銅:約85% が肝臓から胆汁を介して糞便へ、5% 以下が腎臓から尿中へ排泄される。過剰の銅は、再吸収されない形態で胆汁を経て糞便へ排泄される2)。
- ④マンガン:門脈を経て肝臓に運ばれ、胆汁、膵臓、腸から腸管に分泌されてその大半が排泄される。したがって、体内のマンガン量は胆汁排泄によって調節される2)。
- ⑤ヨウ素:甲状腺ホルモンから遊離したヨウ素、及び血漿中ヨウ素は、最終的にその90% 以上が尿中に排泄される。このため、尿中ヨウ素は直近のヨウ素摂取量のよい指標である2)。
マンガンの食事摂取基準 亜鉛の食事摂取基準
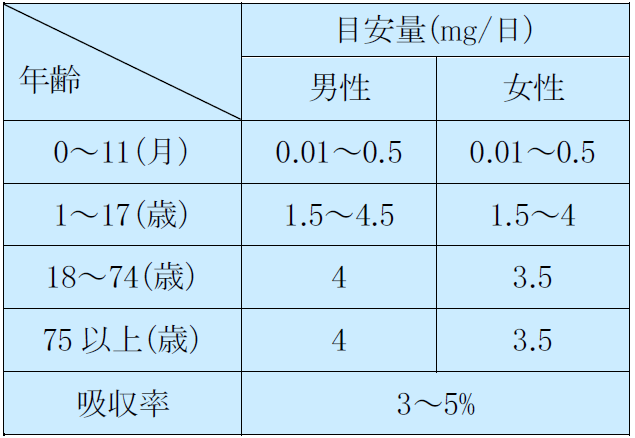
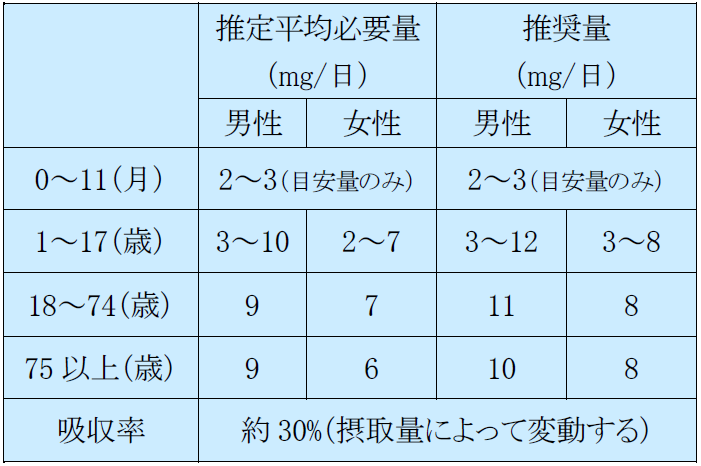
銅の食事摂取基準 ヨウ素の食事摂取基準
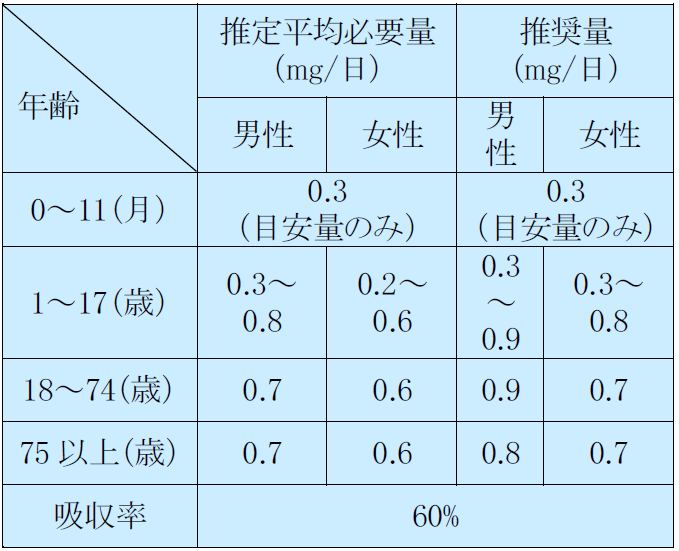
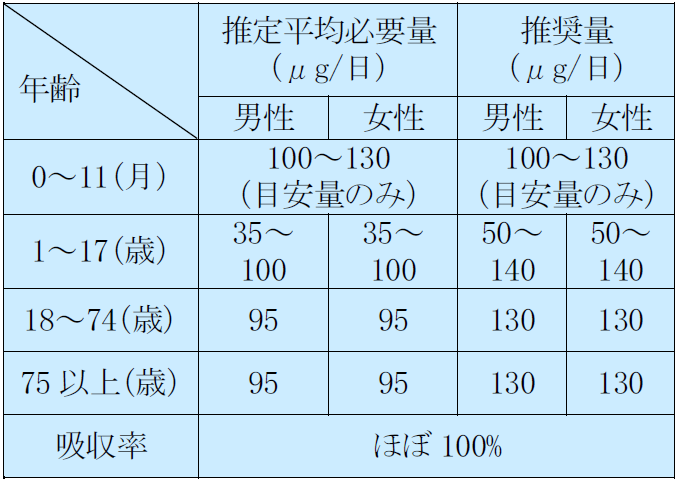
表7 1日あたりの微量元素必要量
セレンの食事摂取基準
4.添付文書に記載されている内容4)(抜粋)
4.1 禁忌事項
【マンガン含有製剤、エルネオパ®NF、ワンパル®】
- 胆道閉塞のある患者[排泄障害により、マンガンの全血中濃度、及び銅などの微量元素の血漿中濃度を上昇させるおそれがある]
- 本剤又は本剤配合成分に過敏症の既往歴のある患者
【マンガン非含有製剤】
- 胆道閉塞のある患者[排泄障害により、銅などの微量元素の血漿中濃度を上昇させるおそれがある]
- 本剤又は本剤配合成分に過敏症の既往歴のある患者
4.2 用法及び用量
【マンガン含有・非含有共通、エルネオパ®NF、ワンパル®を除く】
通常、成人には1日2mLを高カロリー静脈栄養輸液に添加し、点滴静注する。なお、年齢、症状に応じて適宜増減する。
【セレン】
通常、成人及び12歳以上の小児にはセレンとして1日100μgを 開始用量とし、高カロリー輸液等に添加し、中心静脈内に点滴 静注する。以後は、患者の状態により1日50~200μgの間で 適宜用量を調整するが、効果不十分な場合には1日300μgまで中心静脈内に点滴静注することができる。
通常、12歳未満の小児にはセレンとして1日2 μg/kg(体重 50kg以上の場合は100μg)を開始用量とし、高カロリー輸液 等に添加し、中心静脈内に点滴静注する。以後は、患者の状 態により1日1~4 μg/kg(体重50kg以上の場合は50~200μg) の間で適宜用量を調整し中心静脈内に点滴静注する。
なお、本剤の1日投与量を1日1回末梢静脈内に点滴静注又は緩徐に静脈内注射することもできる。
4.3 用法及び用量に関連する使用上の注意
【マンガン含有製剤】
黄疸がある場合、又は本剤投与中にマンガンの全血中濃度の上昇が認められた場合には、マンガンが配合されていない微量元素製剤の投与を考慮すること。また、銅などの微量元素の血漿中濃度の上昇が認められた場合には、休薬、減量もしくは中止等を考慮すること。
【エルネオパ®NF、ワンパル®】
黄疸がある場合又は本剤投与中にマンガンの全血中濃度の上昇が認められた場合及び銅などの微量元素の血漿中濃度の上昇が認められた場合には、投与を中止し、他の高カロリー輸液療法を考慮すること。
【マンガン非含有製剤】
本剤投与中に銅などの微量元素の血漿中濃度の上昇が認められた場合には、休薬、減量若しくは中止等を考慮すること。
【セレン】
(1) 本剤投与開始時及び用量変更時には、血清セレン濃度の確認を行うこと。また、本剤投与中は過量投与に注意し、血清セレン濃度を確認し同一用量を漫然と投与しないこと。
(2) 本剤の増量を行う場合は、増量幅をセレンとして1日あたりの用量で12歳以上の患者では50μg、12歳未満の患者では1μg/kg(体重50kg以上の場合は50μg)までとすること。
4.4 使用上の注意
4.4.1 慎重投与(次の患者には慎重に投与すること)
【マンガン含有製剤、非含有製剤、エルネオパ®NF、ワンパル®】
- 肝障害のある患者 [微量元素の血漿・全血中濃度を上昇させるおそれがある]
- 腎障害のある患者 [微量元素の血漿・全血中濃度を上昇させるおそれがある]
4.4.2 重要な基本的注意
【マンガン含有製剤、エルネオパ®NF、ワンパル®】
本剤を長期連用する場合には、以下の点に注意すること。
- 臨床症状の推移を十分観察したうえで、慎重に投与すること。また、必要に応じ、マンガンの全血中濃度、及びその他の微量元素の血漿中濃度を測定することが望ましい。
- 特に、マンガンについては、マンガン20μmol配合微量元素製剤※)の投与により全血中濃度の上昇がみられたり、脳内蓄積によって脳MRI 検査(T1強調画像)で高信号を示したり、パーキンソン様症状があらわれたとの報告がある。このような所見がみられた場合には、マンガンが配合されていない微量元素製剤の投与に切りかえる等適切な処置を行うこと。
※)マンガン20μmol、鉄35μmol、亜鉛60μmol、銅5μmol、ヨウ素1μmol配合製剤。
【マンガン非含有製剤】
本剤を長期連用する場合には、以下の点に注意すること。
- 臨床症状の推移を十分観察したうえで、慎重に投与すること。また、必要に応じ、微量元素の血漿中濃度を測定することが望ましい。
- 本剤はマンガンが配合されていないため、マンガンの全血中濃度が基準値以下になるおそれがあるので、必要に応じマンガンの全血中濃度を測定し、マンガン配合微量元素製剤の投与を考慮すること。
4.5 副作用
【マンガン含有製剤(ミネリック®-5配合点滴静注シリンジ以外)】
- 0.1~5%未満:発疹、肝機能異常(AST(GOT)上昇、ALT(GPT)上昇、Al-P上昇等)、血中マンガン上昇
- 頻度不明※1):ビリルビン上昇、パーキンソン様症状 ※1))自発報告又はマンガン20μmol配合微量元素製剤で認められた副作用(エレジェクトⓇ注シリンジには自発報告の記載なし)
【マンガン含有製剤(ミネリック®-5配合点滴静注シリンジ)】
副作用発現頻度が明確となる調査を実施していないので、上記いずれの副作用も頻度不明となっている。
【マンガン非含有製剤】
- 0.1~5%未満:発疹、肝機能異常(AST(GOT)上昇、ALT(GPT)上昇、Al-P上昇等)
- 頻度不明※2):発疹、ビリルビン上昇
※2)マンガン配合微量元素製剤で認められた副作用
【エルネオパ®NF】
-
0.1~5%未満:血中マンガン上昇※3))、等
※3)高カロリー輸液用微量元素製剤でみられる副作用
【ワンパル®】
※3)高カロリー輸液用微量元素製剤でみられる副作用
【セレン】
4.6 適用上の注意
【マンガン含有製剤、マンガン非含有製剤】
4.6.1 調整時
- 本剤は光により濁る場合があるので、液の性状を観察し、液が澄明でないものは使用しないこと。
- 本剤は直接高カロリー静脈栄養輸液に添加すること(他の注射剤との直接混合は、沈殿等の配合変化を起こすことがある)。なお、本剤とビタミン剤(B2及びC剤、配合剤)をシリンジ内で直接混合した場合、沈殿によりフィルターの目づまりが生じることがあるので、別々のシリンジを用いること。(図1~8)。
【セレン】
沈殿の認められるもの又は混濁しているものは投与しないこと。なお、還元剤(ビタミンC等)との混合によりセレンの沈殿が生じるおそれがあるため、配合変化に十分注意すること。
(以下、ビタミンをVと表記する)写真は、VB2製剤、VC製剤、VB1・VB6・VB12製剤+整理食塩液、及びTPN用総合ビタミン製剤+注射用水と、マンガン含有製剤のシリンジ内の配合の様子。実際にTPN基本液などに配合していないのであくまでも参考だが、配合直後は肉眼では沈殿は認められなかったが、6時間後はVB2及び高カロリー輸液用総合ビタミン製剤と配合した場合は肉眼で沈殿が認められた。VCと配合した場合は、配合後、黒色の溶液となり沈殿の生成を確認することが困難であった。


VB2(20mg/1mL)とマンガン含有製剤(2mL)をシリンジ内で直接混合した写真。
混合直後(図1)では肉眼では沈殿は認められなかったが、6時間後(図2)では、肉眼ではっきりと沈殿を確認することができた。


VC(100mg/1mL)とマンガン含有製剤(2mL)をシリンジ内で直接混合した写真。
混合直後(図3)から褐色に変色して肉眼での沈殿の生成の確認が困難であった。
6時間後(図4)ではほぼ黒色になり、肉眼で沈殿を確認することは困難であった。


VB1・VB6・VB12製剤+生理食塩水液20mLとマンガン含有製剤(2mL)をシリンジ内で直接混合した写真。
混合直後(図5)、及び6時間後(図6)どちらも肉眼で沈殿を確認することができなかった。


TPN用ビタミン製剤+注射用水20mLとマンガン含有製剤(2mL)をシリンジ内で直接混合した写真。混合直後(図7)では肉眼では沈殿は認められなかったが、6時間後(図8)では、肉眼ではっきりと沈殿を確認することができた。また、溶液の色が赤褐色から黄色に変化していた。
4.6.2 投与経路
【マンガン含有製剤、マンガン非含有製剤】
高カロリー静脈栄養輸液に必ず添加して使用し、直接静脈内に投与しないこと。
なお、セレン製剤は1日投与量を1日1回末梢静脈内に点滴静注又は緩徐に静脈内注射することもできる(4.2 用法及び用量参照)。
5.その他
5.1 微量元素とビタミンの相互作用
糖質・電解質・アミノ酸のバック製剤に、微量元素製剤と総合ビタミン剤を混合調剤した後のビタミンの経時的安定性を検討した報告では、微量元素存在下ではビタミンCの含量低下が報告されている5)。エルネオパ®(販売終了)は、製造時の溶存酸素量を除去するとともに、高いガスバリア性を有する輸液バックを採用することで、混合調剤後のビタミンCの安定化が図られている6)。
5.2 静脈用鉄製剤について
体内における静脈用鉄製剤の鉄の代謝は閉鎖性回路であり、長期の投与になると鉄過剰症を引き起こす可能性がるため、貧血のない患者への長期鉄製剤投与は常に鉄過剰症の可能性を考えておき、血清鉄のみではなく血清フェリチンの測定も鉄過剰症の予防に必要であるという報告がある7)。
また、アルカリ性かつコロイド製剤なので、酸性側に移行させると混濁・沈殿がみられる、混濁・沈殿がみられなくてもコロイドが不安定になり吸収されない遊離鉄イオンが生じる、などの配合変化が起こりやすいので、側管から投与する場合は、ライン内での配合変化を避けるためメインの輸液を止めて、静脈用鉄製剤の投与前後はフラッシュするべきである。
5.3 シリンジ製剤の特徴
ガラスアンプル製剤は、アンプルカット時のガラス片の混入や、アンプルから吸引するときに手指の接触による汚染や怪我などが考えられる。プラスチックアンプル製剤でもプラスチック片の混入が報告されている8)。また、いずれも針刺し事故の危険性もある。シリンジ製剤の場合、プレフィルドシリンジおよびプレフィルドシリンジ専用ホルダーを使用することで、上記の危険性が軽減できると考える。
文献
- Task Force for the Revision of Safe Practices for Parenteral Nutrition. JPEN. 2004;28(6):S52-57
- 日本人の食事摂取基準2020年版
- フェジン®静注40mgインタビューフォーム
- 高カロリー輸液用微量元素製剤 各社添付文書
- 清水弘子ほか:新薬と臨牀J.New Rem.&Clin.57:732-740,2008
- 松原肇ほか:医療薬学36:10-17,2010
- 東海林徹:静脈経腸栄養26:1077-1083,2011
- 正岡康幸ほか:医療薬学37:643-648,2011



