- PDNレクチャーとは?
- Chapter1 PEG
- Chapter2 経腸栄養
- Chapter3 静脈栄養
- 1.末梢静脈栄養法(PPN)
- 1.1 PPNの特徴と適応
- 1.2 PPN製剤の種類と適応
- 1.3 PPNカテーテルの種類
- 1.4 PPNカテーテルの留置と管理
- 2.中心静脈栄養法(TPN)
- 2.1 TPNの特徴と適応
- 2.2 CVカテーテルの種類
- 2.3 CVカテーテル留置法
- 2.4 皮下埋め込み式CVポートと
その留置法 - 2.5 PICCとその留置法
- 2.6 エコーガイド下での
CVカテーテル留置法 - 2.7 TPN時の使用機材
- 2.8 TPN基本液とキット製剤の種類と特徴
- 2.9 アミノ酸製剤の種類と特徴
- 2.10 脂肪乳剤の種類と特徴
- 2.11 TPN用ビタミン製剤の種類と特徴
- 2.12 微量元素製剤の種類と特徴
- 2.13 TPNの実際の投与方法と管理
- 2.14 TPNの合併症
- 2.15 特殊病態下のTPN
- 2.16 小児のTPN
- 2.17 TPN輸液の調製方法
- 2.18 HPN(在宅経静脈栄養)
- Chapter4 摂食・嚥下リハビリ
- PDNレクチャーご利用にあたって




2025年3月版
<Point>
- 現在、本邦の市販されている脂肪乳剤は大豆油由来のみであり、大豆油トリグリセリド(TG:中性脂肪)が主成分となっている。これに乳化剤として精製卵黄レシチンが加えられている。
- 脂肪乳剤の投与の意義は、エネルギー投与と必須脂肪酸の供給にある。
- 脂肪乳剤は生体のカイロミクロンに似た構造の人工脂肪粒子が溶液内に浮遊している。
- 日本人における脂肪乳剤TGの投与速度の上限は0.1g/kg/hrとされる。人工脂肪粒子が十分代謝されるように、ゆっくり投与することが大切である。
1. 脂肪乳剤の開発と本邦の脂肪乳剤
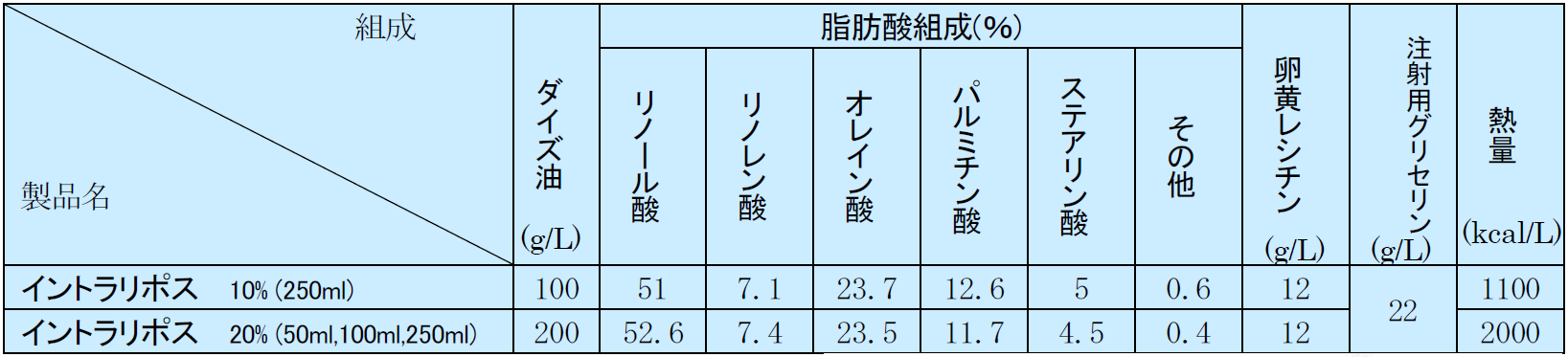
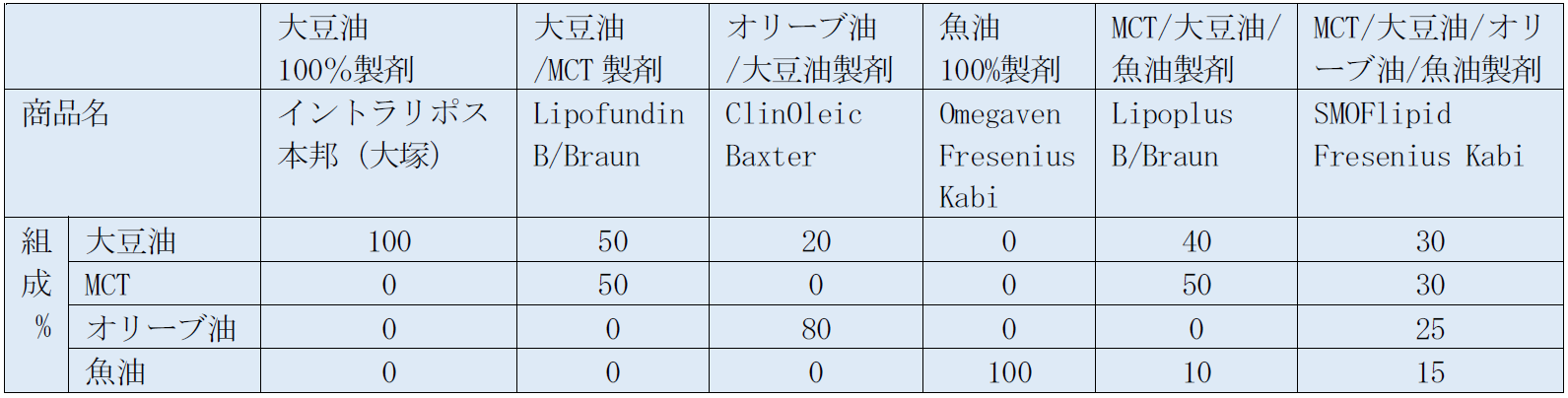
脂肪乳剤は、静脈栄養の三大栄養素の一つとして臨床で広く用いられている。初めに大豆油で作られた脂肪乳剤が開発された。大豆油はその脂肪酸組成においてn-6系多価不飽和脂肪酸のリノール酸の含有量が多い。リノール酸は、生体内で代謝されて、その代謝産物のエイコサノイドは生体の炎症を惹起させる作用があるため、免疫能の低下や全身の炎症反応の悪化を引き起こす可能性があり、理論的には大豆油由来の脂肪乳剤は長期投与や重症患者への投与には慎重を要すると考えられる。この大豆油由来の脂肪乳剤の欠点を緩和するために、生物活性の少ない他の脂肪、中鎖脂肪酸(MCT)やオリーブオイルを混ぜた製剤が開発されてきた。一方、n-3系多価不飽和脂肪酸を豊富に含む魚油を使用することで、炎症反応を抑えるというn-6系にない有用な作用を持つと考えられる脂肪乳剤も開発されてきた1)。 しかし、本邦において市販されている脂肪乳剤は、2024年現在、大豆油由来のイントラリポスのみである(表1)。主成分は、大豆油トリグリセリド(TG:中性脂肪)で、これに乳化剤として精製卵黄レシチンが加えられている。また、等張化剤として静注用グリセリンが添加され、浸透圧比1と等張である。pHは7.5程度で中性に近く、白色のエマルジョンとなっている。10%と20%の製剤が市販されており、10%脂肪乳剤は1.1kcal/ml、20%脂肪乳剤は2.0kcal/mlのエネルギーを有する。10%でも20%でも乳化剤のレシチンの量は同じであるので、20%製剤の方が同じエネルギー投与であれば、レシチン量は少なくて済む。 我が国で市販されていないMCT、 オリーブオイル、魚油などの脂肪乳剤は、多くの国々で使用されており、最近は、大豆油を含めたいくつかの脂肪をミックスした脂肪乳剤が世界(特にヨーロッパ)の主流となってきている。しかし、本邦では、いまだに大豆油の脂肪乳剤しか認可されていないのが現状である(表2)。
原料は大豆油で、大豆油トリグリセリド(TG:中性脂肪)が主成分となっている。これに乳化剤として精製卵黄レシチンが加えられている。また、等張化剤として静注用グリセリンが添加され、浸透圧比1と等張である。pHは6.5~8.0で中性であり、白色のエマルジョンとなっている。10%と20%の製剤が市販されており、10%脂肪乳剤は1.1kcal/ml、20%脂肪乳剤は2.0kcal/mlのエネルギーを有する。10%でも20%でも乳化剤のレシチンの量は同じであるので、20%製剤の方が同じエネルギー投与であれば、レシチン量は少なくて済む。
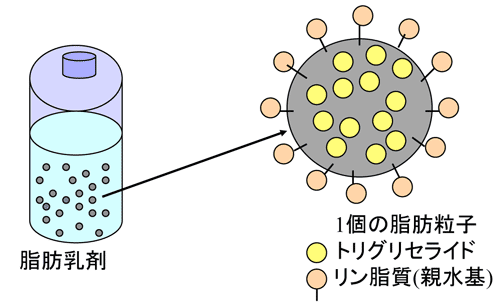
2.脂肪乳剤の構造(図1)
脂肪乳剤は生体のカイロミクロンに似た構造の人工脂肪粒子が溶液内に浮遊している状態の溶液である。人工脂肪粒子の中心は多数のTG分子(α-トコフェロールなども含まれる)で構成され、その周りは1層のリン脂質が存在し(そこには遊離のコレステロールやフィトステロールも存在する)、その親水性の部分が表面に向いている1)(図1)。リン脂質は乳化剤の卵黄のレシチンで、このような形態で水に溶けるようになり、乳化されている。人工脂肪粒子の大きさは100~700nm (0.1-0.7μm)で平均は200~400nm (0.2-0.4μm)である。米国の基準では粒子径は平均500nm(0.5μm)未満で、5μmより大きな粒子が0.05%未満とされている。人工脂肪粒子の多くは200nm(0.2μm)のフィルターを通過しない。フィルターを使用する場合は、脂肪乳剤用のフィルター(孔径1.2μm)のフィルターを用いる。
静脈投与するにあたって脂肪乳剤の粒子径は重要である。大きすぎると組織に脂肪蓄積を起こし、組織に酸化ダメージを与える。肝臓ではKuffer細胞や網内系に取り込まれて、肝脾腫の原因となる3)。また、肺の微小循環にトラップされ、呼吸障害を引き起こす原因ともなるといわれている。
小さな粒子径の脂肪乳剤の方が血中での脂肪輸送に理想的であり、安定性、溶解性ともに高い。リン脂質:TGの比が大きくなれば、乳化剤のリン脂質が増えるので、脂肪乳剤の粒子を小さくできる4)。逆に、乳化剤のリン脂質に比較しTGが多ければ、5μm以上の粒子が増える。また、一方で乳化剤であるリン脂質が多すぎると、小さな径の80-100nmのリポゾームのような構造の粒子が形成され、それが脂肪代謝を傷害し、蓄積して、生体に不利に働くといわれている5)。とくに脂肪乳剤の10%製剤では、乳化剤が多く含まれるため、この傾向が強いといわれている。
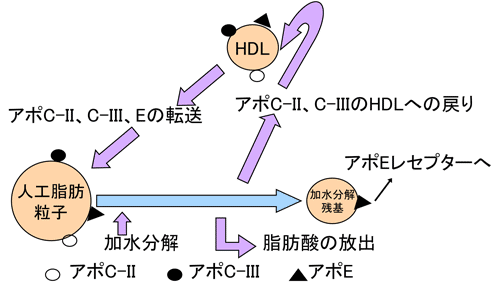
3.脂肪乳剤の代謝
静脈投与された脂肪乳剤は、胸管から血中にはいったカイロミクロンとほぼ同様に代謝される1)(図2)。脂肪乳剤の人工脂肪粒子は血中の高密度リポ蛋白(HDL)からアポ蛋白C-II、C-IIIとEが転送され、結合して(これを人工脂肪粒子のリポ蛋白化と呼ぶ)、アポ蛋白C-IIとC-IIIは毛細血管壁に存在する加水分解酵素リポ蛋白リパーゼ(LPL)を調節し、血管内で人工脂肪粒子のTGは脂肪酸とモノグリセロールに加水分解を受け、近くの組織に取り込まれる。遊離脂肪酸の一部は血中にとどまり、ほとんどはアルブミンと結合し、循環する。
Eは加水分解残基(レムナント)に残り、肝細胞のEレセプターに認識され、取り込まれる23)。レセプターを介さない細胞内への取り込みも存在する。また、レムナントは肝臓以外の臓器にも取り込まれる。レムナントの細胞内への取り込みはn-3系脂肪酸やトコフェロールなどの脂溶性ビタミンの輸送に重要な役割を持つ。
加水分解されたのち、アポ蛋白C-II, C-IIIはHDLに戻り、次に進入してくる人工脂肪粒子に絶え間なく転送される。脂肪乳剤が効率よくアポ蛋白を結合してリポ蛋白化され、順調に加水分解され代謝されるのには投与速度に限界がある。大豆油製剤に関して、日本人における脂肪乳剤TGの投与速度の上限は0.1gTG/kg体重/時間とされる6)。これを上回った速度で投与すると、血中TGが上昇をはじめ、人工脂肪粒子が加水分解されずに血中に停滞することになる。この原因はHDLより人工脂肪粒子に転送されるアポ蛋白量には限度があるからで、HDLに含まれるアポ蛋白の約20%しか転送されない7)。リポ蛋白化されない人工脂肪粒子はエネルギーとならずに、異物として網内系に認識され貪食され、それにより免疫能が低下する可能性もある。
4.脂肪乳剤の臨床的意義
脂肪乳剤の投与の主な意義は、エネルギー投与と必須脂肪酸の供給にある。脂肪から得られるエネルギーは9kcal/gと高く、効率の良いエネルギー基質である。一般的に日本人は摂取エネルギーの20~30%を脂肪から摂取している。
多くの脂肪酸はブドウ糖やアミノ酸の共通の代謝産物であるアセチルCoAから、肝臓、脂肪組織、乳腺組織で産生される。しかし、哺乳類はn-3、n-6系多価不飽和脂肪酸を生体内で作ることができないので、それらは必須脂肪酸と称され、食事から摂取しなくてはならない。不十分にしか必須脂肪酸の摂取できない場合、必須脂肪酸欠乏症(EFAD)を引き起こすことになる。EFADの特徴的な臨床的症状は、皮膚病変、成長障害、発達障害、全身倦怠感、不妊症、易感染性などである。長期のTPN時にも、脂肪乳剤の静脈投与によってEFADは回避できる。必須脂肪酸欠乏を予防するためには、1週間に50gの脂肪乳剤を投与すればよいといわれている。ガイドラインでは、静脈栄養施行時には、必須脂肪酸欠乏症予防のため、脂肪乳剤は投与しなくてはならないとなっている8)。
その他にも、脂肪酸は、細胞膜の構成成分や、細胞内のシグナル伝達系のメッセンジャー、炎症や血小板機能を司る物質の前駆物質、コレステロールや内因性のステロイドの産生に必要な物質であり、生物になくてはならないものである。そのため、ガイドラインではTPNには原則として脂肪乳剤を投与するとされている。
静脈栄養施行時に脂肪を入れず、非タンパクエネルギーを糖質のみとすると、糖質が過剰となり脂肪肝やTPN関連肝障害を引き起こす可能性がある。ガイドラインでも、静脈栄養施行時には、肝機能障害ならびに脂肪肝発生予防のために脂肪乳剤投与は有用とされている8)。
また、末梢静脈栄養(PPN)施行時においても、脂肪乳剤はエネルギー密度が高いので、投与エネルギーを増加させるうえで有利であるとされている。また、脂肪乳剤は低浸透圧であるので、PPN製剤と同時に投与することで浸透圧を下げ、血栓性静脈炎の発生予防に有用である8)。本邦のPPN製剤はアミノ酸量が多く含まれており、NPC/N比が低いので、NPC/N比を適正に保つためにも脂肪乳剤の併用が有用とされている8)。このようにTPNばかりでなく、PPNにおいても脂肪乳剤の使用は推奨されている。
5.脂肪乳剤に含まれているn-6系、n-3系多価不飽和脂肪酸に関して
脂肪乳剤のTGを構成する脂肪酸組成には、必須脂肪酸を過不足なく含み、必須脂肪酸欠乏症(EFAD)を起こさないことが求められる。また、生体の炎症反応や免疫能を生体に不利になるような方向へ導かない脂肪酸組成も求められる。
そのためには、必須脂肪酸であるn-6系、n-3系多価不飽和脂肪酸がEFADを予防できるに足る量を含有し、かつ、n-6系:n-3系の比率も重要となる9)。n-6系であるリノール酸(LA)とその代謝産物であるアラキドン酸(ARA)は2シリーズprostaglandin、4シリーズleukotrieneの代謝の前駆体となっており、それらのエイコサノイドはpro-inflammatoryの性質を有しており、免疫能の低下や全身の炎症反応の悪化を引き起こす可能性がある10)。一方、n-3系のα-リノレン酸(ALA)とその代謝産物のEPA. DHAはanti-inflammatoryを示す3シリーズprostaglandin、5シリーズleukotriene、そして炎症を収束させる因子であるresolvinやprotectin、maresinなどの代謝の前駆物質となっている。n-6系とn-3系は代謝酵素の基質として拮抗するため、n-3系の比率が高ければ、n-6系から産生される炎症惹起作用の強いエイコサノイドの量が低下することとなり、炎症を抑制する作用が強くなる。実験的にも、生体内で、DHA, EPAがマクロファージの細胞膜に多ければ、LPSの作用によるIL-6やTNF-αの産生が落ち、炎症反応が抑制されることが知られている11)。また、食物中のn-6系:n-3系の比が高いとpro-inflammatoryのバイオマーカーが高値をしめし、血小板凝集反応も促進されるという12)。そのため、必須脂肪酸の内容と比率は脂肪乳剤で重要事項である。
6. 大豆油脂肪乳剤に関して
大豆油は世界で初めて開発された静注用の脂肪乳剤の原料のオイルである。n-6系多価不飽和脂肪酸が多く含有されている(表3)。脂肪酸組成の約50%はn-6系のリノール酸(LA)で、n-3系のアラキドン酸(ALA)は10%、n-9系のオレイン酸(OA)を25%、短鎖脂肪酸(SFA)を15%ほど含有している9)。大豆油はEFADを回避するに足る十分な必須脂肪酸を含有している。エネルギーと必須脂肪酸含有という面からは、大豆油は良い選択であるが、n-6/n-3の比率が5:1程度と高く、炎症を惹起させる可能性があり、重症患者に悪影響を及ぼしSIRSを引き起こさないかの懸念が挙げられるという。
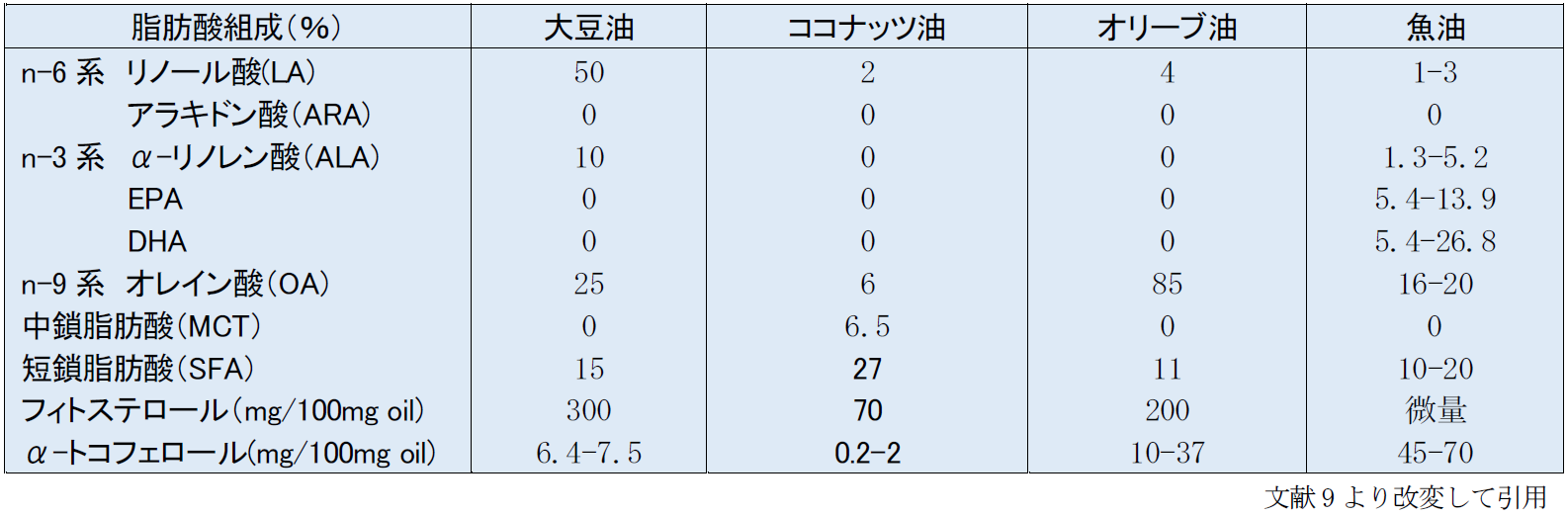
大豆油は肝障害を起こす可能性のあるフィトステロールが300mg/100g oilと豊富に含有している。一方、ビタミンEファミリーで抗酸化作用のあるあるα-トコフェロールの含有量は低く、6.4-7.5mg/100g oil程度である9)。
本邦では、大豆油のみから作られたイントラリポス(10%、20%製剤)が市販されており、これが唯一の静注用脂肪乳剤として認可されている。大豆油脂肪乳剤は、必須脂肪酸欠乏症(EFAD)を回避するのに十分な必須脂肪酸を含んでいる。しかし、LAが豊富で、n-6系:n-3系比が7:1と高く、欠点として、Pro-inflammatory のエイコサノイドの過剰や酸化ストレス増強が考えられる10)。また、フィトステロールを豊富に含んでいるため、肝障害を引き起こしやすい可能性も指摘されている。そのため、大豆油製剤はエネルギー源や必須脂肪酸の補給には適しているが、敗血症や重症患者などの免疫機能のバランスが崩れた特別な病態の患者の使用に適さないと考えられている。
しかし、一方で、大豆油製剤の欠点を指摘する基礎や動物実験などは、臨床的な血中濃度の範囲を超えたレンジでの実験も多く、免疫系への反応に関しては、必ずしも、臨床的な効果や副作用を表していない可能性もあることに留意すべきであろう。また、臨床的な検討でもバイアスが強いものやエビデンスレベルが低いものが多く、新しい脂肪乳剤に比較して大豆油製剤が臨床的に劣るとは言えないとも考えられている24)。
腸管の障害により、長期にTPNが必要となる小児に発症するPNALD (PN-associated liver disease)は、大豆油製剤と関連が深いと考えられている。胆汁うっ滞、肝障害により肝硬変に至るPNALDは、未熟児、低出生体重、経腸栄養を使用せずに長期の静脈栄養の使用、外科手術などがリスクファクターとなる13)。脂肪乳剤を大豆油製剤から魚油製剤に変更すると、PNALDが改善されることが報告されている14)。疾患の誘発原因の一つとして、大豆油製剤に高濃度に含まれるフィトステロールが考えられている。加えて、大豆油製剤のn-6系:n-3系比が高いこと、抗酸化物質であるα-トコフェロールも少ないことも原因と考えられている。
7. 脂肪乳剤の使用上の注意点
大豆油脂肪乳剤の使用上の注意点を挙げる。投与速度を遵守し、衛生管理を十分配慮して投与することが重要である。
7-1 投与速度について
本邦の大豆油100%製剤は、0.1gTG/kg体重/時間以下の速度で投与するのが望ましいとされる。TGクランプを行う実験で0.3Kg/kg体重/時間で投与した時は血中のTGが上昇したのに対し、0.1g/kg体重/時間以下では上昇がみられなかった6)。脂肪乳剤の代謝から見ると、脂肪乳剤の投与速度が速すぎるとアポ蛋白の転送が間に合わなくなって、代謝が遅れ、末梢組織での脂肪酸としての利用がされずに、血中のTGが上昇してしまう。そのため、ゆっくりと速度を守って投与することが重要である。脂肪乳剤の投与時には血中のTGをモニターし、TGが300mg/dL未満であることを確認することが推奨される。
MCTが含まれている製剤では脂肪代謝が促進され、短時間で小さなレムナント形成が起こり、組織への取り込みも促進される。そのため、投与速度は0.2gTG/kg体重/時間ほどでよいと考えられる15)。また、魚油製剤に豊富なn-3系のTGはLPLにより代謝されにくいとされ、魚油100%製剤であれば、代謝が遅いので、0.05gTG/kg体重/時間以下の速度で投与するのが望ましいといわれている。
7-2 投与方法
脂肪乳剤の投与は従来、TPN製剤との混合を避けるため、脂肪乳剤投与のために末梢投与経路を別におくことが推奨されていた。しかし、現在はTPNラインの側管からの投与も可能とされている。脂肪乳剤をTPNラインの側管から投与した実験において脂肪乳剤の人工脂肪粒子径や粒子の粗大化がみられず、安全に投与が可能と報告されている16)。脂肪乳剤の人工脂肪粒子はTPNのインラインフィルターの通過が困難のため、インラインフィルターを介さない患者側の側管からの注入することが必要である。一方、TPN製剤に脂肪乳剤を混合した場合は粗大粒子が増え、米国の基準の「5μmよりも大きな粒子の体積が全脂肪の0.05%未満」を越えた。TPN製剤に脂肪乳剤を混合しての投与は行わないようにする。ただし、海外で多く使用されている脂肪を使用直前に混合するTPN用のスリーバッグ製剤に関してはこの限りではない。
7-3 微生物増殖のリスク
脂肪乳剤および脂肪乳剤を含む輸液製剤では、高濃度の糖質とアミノ酸の輸液に比較し細菌や真菌の増殖が速いと報告されている17)。そのため、脂肪乳剤は細菌汚染が容易に起こりやすいとされる。また、脂肪乳剤投与はTPNでのカテーテル関連血流感染症のリスク因子と報告されている18)。このため、ガイドラインで脂肪乳剤投与に利用した輸液ルートは24時間以内に交換することが推奨されている8)。
しかし、適切に注意深くカテーテル管理をした場合は、脂肪乳剤の使用によっても血流感染症が増加することはないと報告も見られる19)。実臨床では、脂肪乳剤の投与時にはとくにカテーテル管理に注意を払う必要があると考えられる。
7-4 重症患者への投与
本邦の大豆油脂肪乳剤は前述したようにn-6系不飽和脂肪酸のリノール酸の含有割合が多いため炎症反応を増強し、免疫能を低下させる恐れがある。そのため高度の侵襲や炎症のある重症患者への投与は慎重を要すると考えられる。ASPENのガイドラインでは経腸栄養が不可能で静脈栄養を施行するICU患者において、当初1週間は大豆油脂肪乳剤の使用は控えることを推奨している20)。しかし、この推奨度は低い。
一方、MCTやオリーブ油、魚油などを含んだ製剤を使用できる状況のヨーロッパのガイドラインでは重症患者にも脂肪乳剤の投与が推奨されている21)。ただし、0.7g/kgを12時間から24時間かけての投与が推奨されており、本邦での推奨速度の0.1g/kg体重/時間よりさらに長時間かけての投与となっている。
重症患者への脂肪乳剤投与の是非はまだまだ議論の余地があるところである。本邦では大豆油脂肪乳剤しか使用できないという状況を踏まえ、深柄は重症患者への脂肪乳剤投与に関して、①適正な投与速度を守る、②過剰な量の投与は行わない、③脂肪乳剤投与に使用した輸液ラインは24時間以内に交換する、④高度な炎症反応が生じている急性期には投与をさける、以上の①~④を考え、脂肪乳剤の問題点を克服しつつ、その利点を生かした輸液管理が重要であると述べている22)。
7-5 高齢者での投与
ESPENの高齢者への静脈栄養のガイドラインによると、脂肪乳剤の代謝は年齢による変化がなく、高齢者においても脂肪乳剤の利用は保たれているという23)。そのため、耐糖能が低くなった高齢者に対して、静脈栄養を行う場合は、投与エネルギーの脂肪比率を上げることも許容できるとされる。その場合ももちろん投与速度と投与量は考慮することが前提である。高齢者にとっても、静脈栄養施行に際して脂肪乳剤はよいエネルギー源となる。
文献
- 丸山道生:各種脂肪乳剤の特徴と代謝、外科と代謝・栄養51:63-72, 2017
- 入山圭ニ:脂肪乳剤の代謝とその使い方、新静脈栄養・経腸栄養ガイド、Medical Practice 26,増刊号:95-98、2009
- Driscoll DF:Lipid injectable emulsions: pharmacopeial and safety issues. Pharm Res 23:1959–69、2006
- Luk AS, Kaler EW, Lee SP. Structural mechanisms of bile salt-induced growth of small unilamellar cholesterol-lecithin vesicles. Biochemistry 36:5633–44, 1997
- Wanten GJA, Calder PC: Imuune modulation by parenteral lipid emulsions. Am J Clin Nutr 85: 1171-84, 2007
- Iriyama K, Tsuchibashi T, Miki C, et al: Elimination rate of fat emulsion particles from plasma in Japanese subjects as determined by a triglyceride clamp technique. Nutrition 12: 79-82, 1996
- 入山圭二:脂肪乳剤の血管内代謝の仕組み、外科と代謝・栄養 43: 89-93, 2009
- 日本静脈経腸栄養学会編集:静脈栄養剤の種類と選択、静脈経腸栄養ガイドライン、P33-46,照林社、東京、2013
- Fell GL, Nandivata P, Gura KM, et al: Intravenous lipid emulsions in parenteral nutrition. Advanced nutrition 6: 600-610, 2015
- Wanten GJA, Calder PC: Imuune modulation by parenteral lipid emulsions. Am J Clin Nutr 85: 1171-84, 2007
- Honda KL, Lamon-Fava S, Matthan NR, et al: EPA and DHA exposure alters the inflammatory response but not the surface expression of Toll-like receptor 4 in macrophages. Lipids 50:121–9, 2015
- Ferrucci L, Cherubini A, Bandinelli S, et al: Relationship of plasma polyunsaturated fatty acids to circulating inflammatory markers. J Clin Endocrinol Metab 91:439–46, 2006
- Christensen RD, Henry E,Wiedmeier SE, et al.: Identifying patients, on the first day of life, at high-risk of developing parenteral nutrition-associated liver disease. J Perinatol 27:284–90, 2007
- de Meijer VE, Gura KM, Le HD, et al.: Fish oil-based lipid emulsions prevent and reverse parenteral nutrition-associated liver disease: the Boston experience. JPEN 33:541–7, 2009
- Oliveira FL, Rumsey SC, Schlotzer E, et al: Triglyceride hydrolysis of soy oil vs fish oil emulsions. JPEN 21: 224-229, 1997
- 井上善文ほか:脂肪乳剤を中心静脈栄養投与ラインに側管投与する方法の安全性―脂肪粒子径からの検討、静脈経腸栄養 29: 863-868, 2014
- Mershon J, Nogami W, Williams JM, et al: Bacterial/fungal growth in a combined parenteral nutrition solution. JPEN 10: 498-502, 1986
- Buchman AL, Opilla M, Kwasny M, et al: Risk factors for the development of catheter-related bloodstream infections in patients receiving home parenteral nutrition. JPEN 38: 744-449, 2013
- Pontes-Arruda A, Leu FX, Turpin RS, et al: Bloodstream infections in patients receiving manufactured parenteral nutrition with vs without lipids is the use of lipids really deleterious? JPEN 36: 421-430, 2012
- McClave SA, Martindale RG, Vanek VW, et al: Guidelines for the provision and assessment of nutrition support therapy in adult critically ill patient: SCCM and ASPEN. JPEN 33: 277-316, 2009
- Singer P, Berger ME, Van der Berghe G, et al: ESPEN guideline on parenteral nutrition: Intensive care. Clin Nutr 28: 387-400, 2009
- 深柄和彦:脂肪乳剤の問題点、静脈経腸栄養 28: 909-913, 2013
- Sobotka L, Schneider SM, Berner YN, et al: ESPEN Guideline on Parenteral Nutrition: Geriatrics, Clin Nutr 28:461-466, 2009
- Singer P, Blaser AR, Berger MM, et al: ESPEN guideline on clinical nutrition in the intensive care unit, Clin Nutri 38: 48-79, 2019



