- PDNレクチャーとは?
- Chapter1 PEG
- Chapter2 経腸栄養
- 1.経腸栄養の特徴と適応
- 2.経腸栄養剤の分類
- 3.病態別経腸栄養剤
- 3.1 病態別経腸栄養剤とは?
- 3.2 肝不全用栄養剤
- 3.3 腎不全用栄養剤
- 3.4 糖尿病用栄養剤
- 3.5 呼吸不全用栄養剤
- 3.6 免疫賦活栄養剤、免疫調節栄養剤
- 4.経腸栄養に用いられる製剤および食品
- 4.1 グルタミン製剤(食品)
- 4.2 微量元素製剤
- 4.3 食物繊維
- 4.4 プロバイオティクス、シンバイオティクス
- ① プロバイオティクス
- ② シンバイオティクス
- 4.5 ORS(経口補水液)
- 4.6 増粘剤、ゲル化剤
- 4.7 脂肪酸
- ① 脂肪酸とその分類
- ② 多価不飽和脂肪酸(ω-3, ω-6系)
- ③ 中鎖脂肪酸(MCT)
- 5.半固形化栄養剤
- 5.1 基礎的な知識
- 5.2 臨床的な知識
- ①胃瘻からの半固形化栄養材
短時間注入法 - ②栄養剤形状機能について
- 6.ミキサー食
- 6.1 ミキサー食(成人)
- 6.2 ミキサー食(小児)
- 6.3 ミキサー食(小児)
- 7.早期経腸栄養
- 8.周術期経腸栄養
- 9.在宅経腸栄養
- 9.1 在宅経腸栄養
- 9.2 在宅診療の医療費の実際
- 9.3 終末期医療にかかる費用
- 10.経腸栄養に必要な器具
- 11.経腸栄養時の薬剤投与
- 12.経腸栄養の管理
- 13.経腸栄養の合併症と対策
- 14.栄養剤使用時の栄養アセスメント
- ●「経腸栄養」関連製品一覧
- Chapter3 静脈栄養
- Chapter4 摂食・嚥下リハビリ
- PDNレクチャーご利用にあたって



Chapter2 経腸栄養
4.経腸栄養に用いられる製剤および食品
4.7 脂肪酸
③中鎖脂肪酸
(medium chain fatty acid: MCFA)
中鎖脂肪
(medium chain triglyceride: MCT)
熊本リハビリテーション病院
サルコペニア・低栄養研究センター長 吉村 芳弘

2025年3月版
<Point>
① 炭素数8~12個の脂肪酸は中鎖脂肪酸(MCFA)とよばれ、中鎖脂肪(MCT)を形成する。
② 長鎖脂肪酸はリンパ管や静脈を経由して肝臓や筋肉に運ばれるが、中鎖脂肪酸はリンパ管を通らずに門脈経由で直接肝臓に運ばれる。
③ カルニチン非依存性で酸化されやすく、長鎖脂肪酸より速やかに吸収され、代謝も速い。カルニチンは脂肪酸をミトコンドリア内に輸送するために必須なビタミン様物質であり、長鎖脂肪酸のβ酸化(分解)を促進する。中鎖脂肪酸(および短鎖脂肪酸)はカルニチンと結合しなくてもミトコンドリア内に輸送されるため、体内への蓄積が少なく、中性脂肪への再合成もほとんどない。
④ 医療現場で中鎖脂肪酸が広く用いられている。特に手術後の患者や未熟児、低栄養や摂食障害、サルコペニアの高齢者に対して、あるいはリハビリテーションとの併用や腎臓病、てんかん、糖尿病などの患者に対する栄養補給として利用されている。
⑤ 最新の話題として、認知症やがん患者に対するケトン食の臨床的改善効果や、摂食亢進ペプチドであるグレリンとの関連が指摘されている。
キーワード:
中鎖脂肪酸、MCFA、中鎖脂肪、MCT、カルニチン、ミトコンドリア、ケトン体、低栄養、高齢者、リハビリテーション
1.はじめに
中鎖脂肪酸(Medium chain fatty acid, MCFA)はココナッツやパームフルーツに含まれる天然成分であり、MCFAで構成された油脂を中鎖脂肪(Medium chain triglyceride, MCT)という。臨床的には、MCFAとMCTはほぼ同じ意味合いで用いられることが多い。MCTは一般的な油脂よりもすばやく消化・吸収され、すぐに熱量として利用されるという特徴を活かし、医療現場やスポーツ分野における栄養補給、さらには生活習慣予防などの様々なシーンで利用されている。また、ケトン体を誘導することでアルツハイマー病やがん患者への臨床効果も期待されている。本稿では、MCTの生理学的側面と臨床現場での活用例について、最新の話題を盛り込みながら概説する。
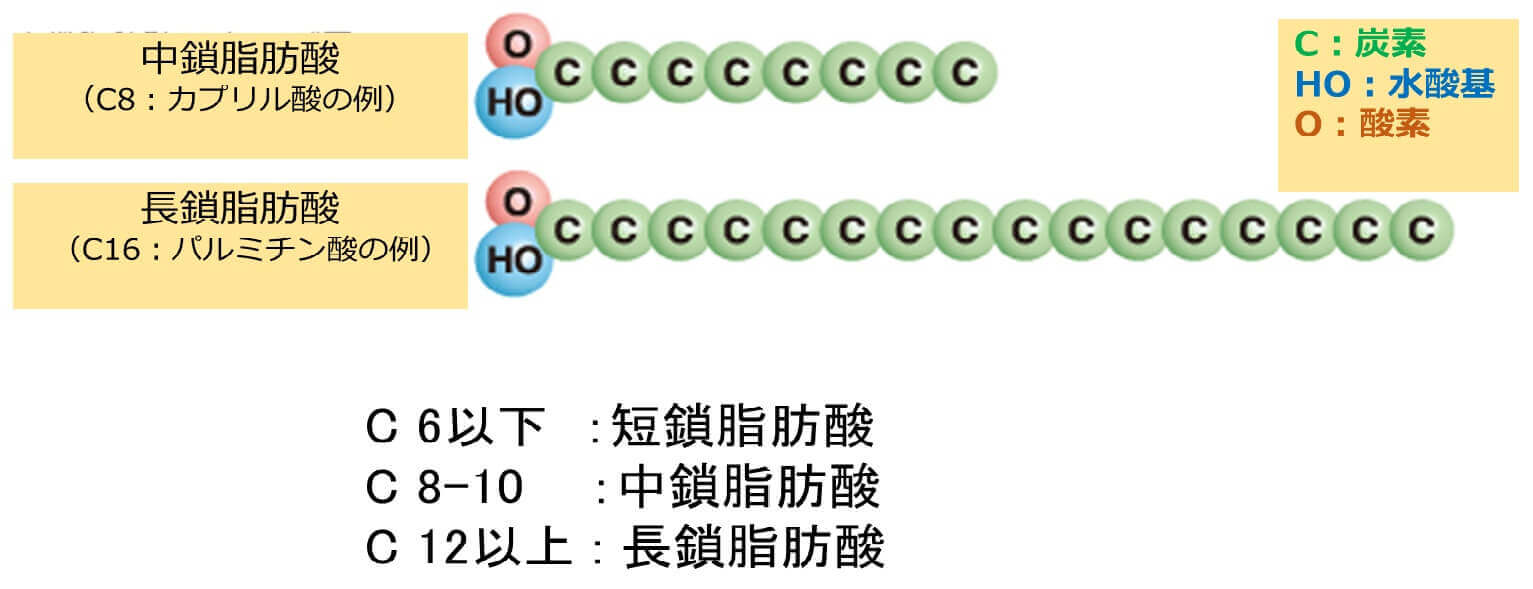
2.MCTとは
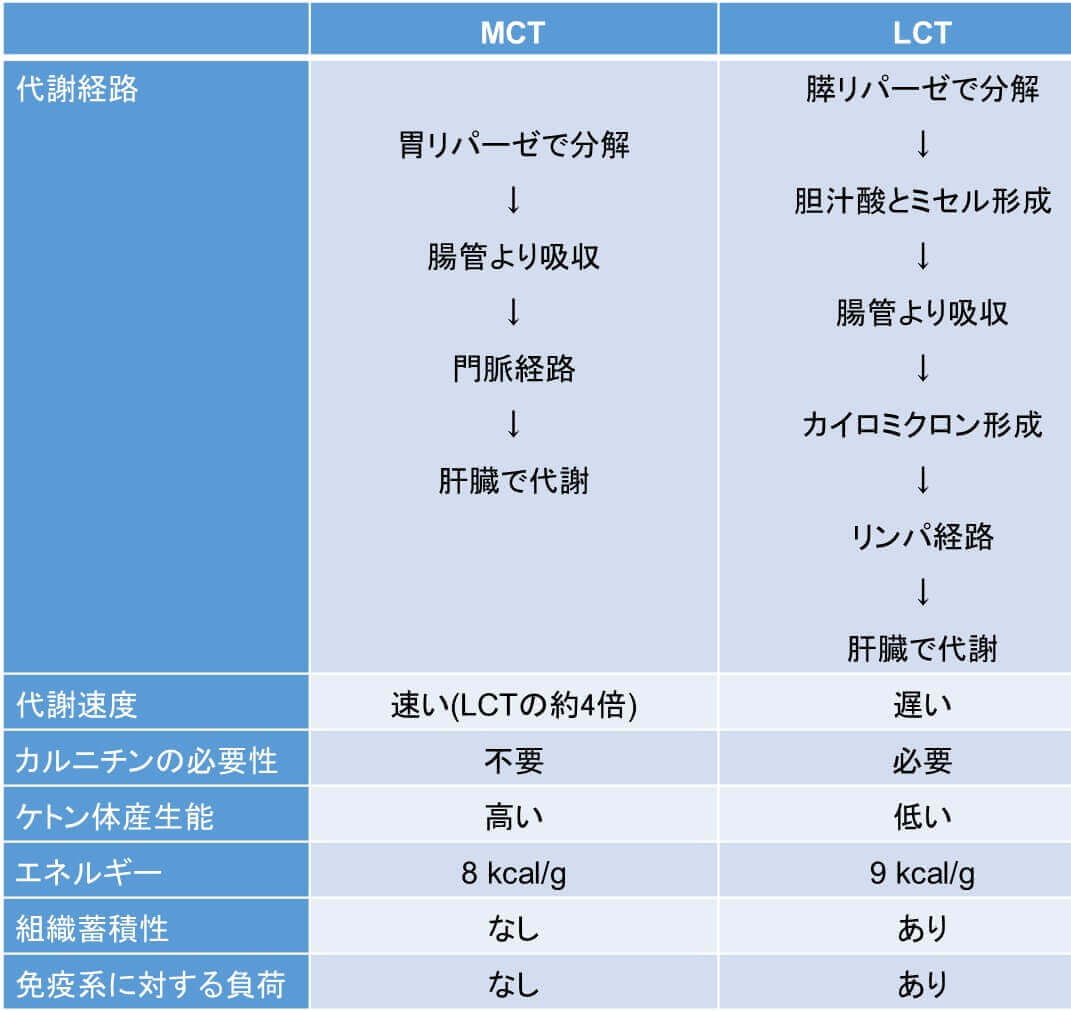
MCTは炭素数8-10個の中鎖脂肪酸で構成される中鎖脂肪(油脂)である(図1)。自然界でMCTを含む油脂は少なく、ヤシ油、パーム油、乳脂などに限られ、含有量も15%程度と少ない。キャノーラ油やオリーブオイル、ラードなどの一般に使用される調理油は、炭素鎖12以上の長鎖脂肪(Long chain triglyceride, LCT)が主な油脂成分である。MCTはLCTの約半分の長さしかないことが特徴であり、この脂肪酸の「長さ」によりMCTとLCTの生理学的特製の違いが生じる。MCTとLCTの比較を表1にまとめる。
3.MCTは肝臓で速やかに代謝される
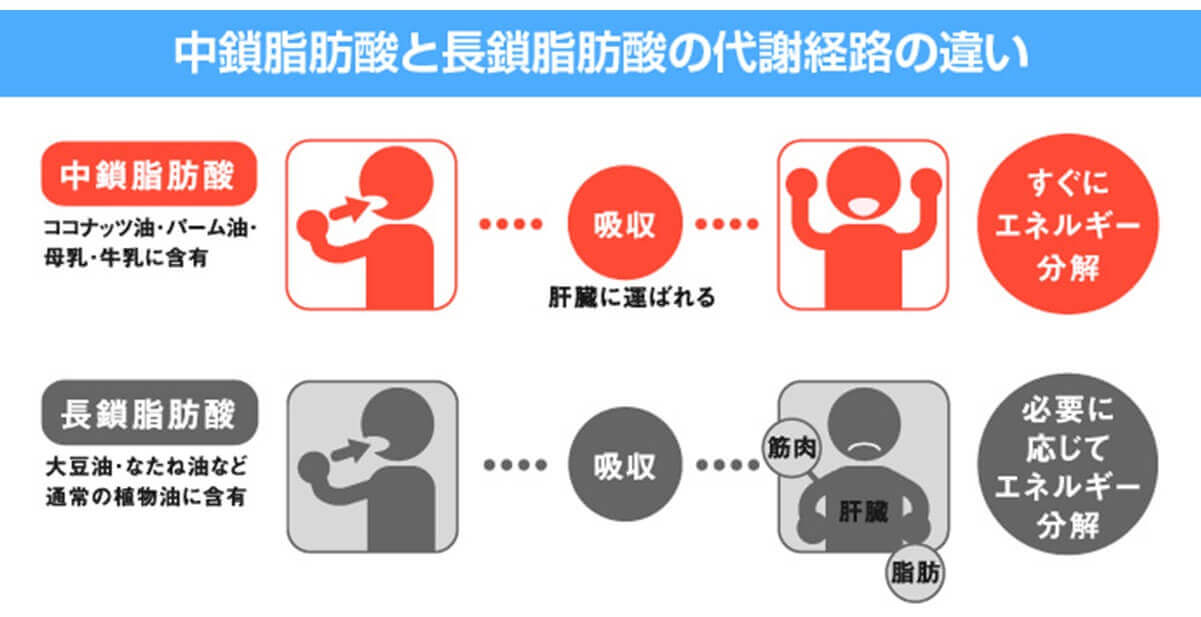
一般的な脂質(主にLCT)は水に不溶性のため、胆汁酸やホスファチジルコリン、コレステロール等によって乳化されたミセルを形成する。ミセルは水溶性で受動拡散によって腸粘膜の吸収上皮細胞内に吸収される。その後、腸壁を通過すると粘膜上皮細胞内で再びグリセロールと結合して中性脂肪となり、蛋白質などと結合しカイロミクロンというリポタンパク質粒子を形成する。カイロミクロンはリンパ管から胸管に入り、鎖骨下静脈から大循環に流入し、主に脂肪組織や筋肉組織に取り込まれ、一旦貯蔵されてからグリコーゲンが枯渇した際に分解されて、ゆっくりとエネルギー源として代謝利用される。つまり、LCTは、糖質が充足されている場合、余剰なエネルギーは体内に蓄積されやすい。
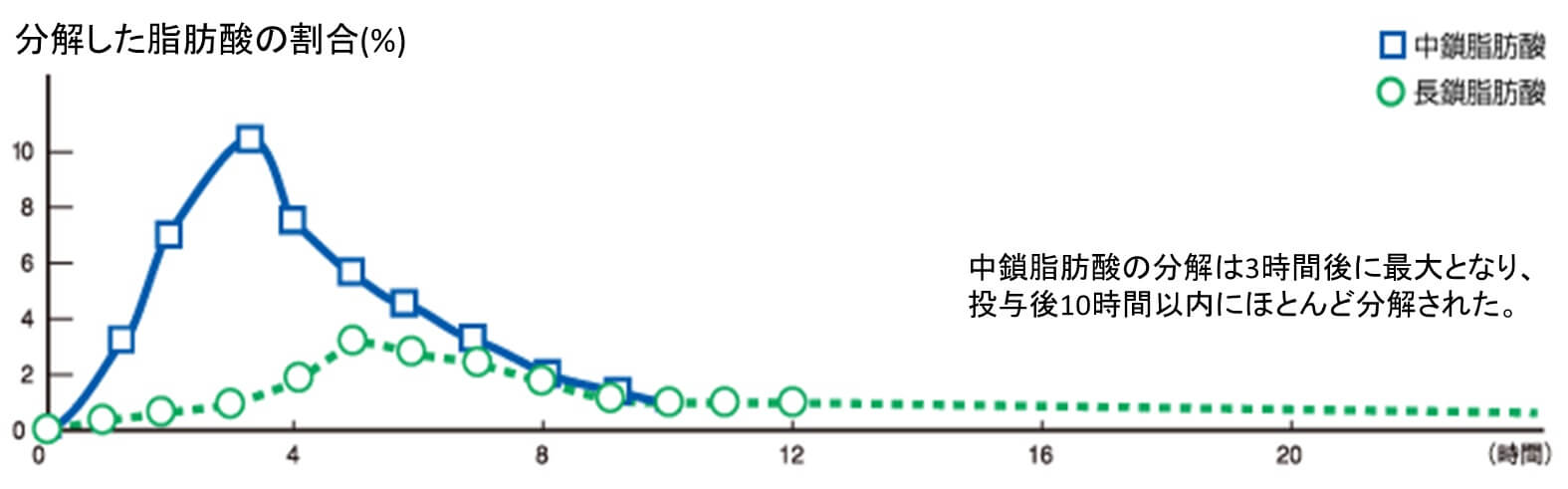
一方で、炭素鎖が短いMCTは水になじみやすく、胆汁酸によるミセル化が不要である。腸粘膜の吸収上皮細胞に容易に吸収され、分子が小さいことから腸管で毛細血管に容易に吸収され、カイロミクロンを形成せずに直接門脈に流入する。門脈から肝臓へ運ばれたあとは速やかにエネルギー源となって代謝される。脂質代謝においては、LCTがβ酸化のためにミトコンドリア内膜に輸送される際にはカルニチンをキャリアとして必要とするが、MCTはカルニチンの助けなしにミトコンドリア内に取り込まれて、速やかに代謝される。つまり、MCTは、消化吸収およびエネルギー利用が速く、効率よく分解されて体脂肪として蓄積しにくい、という特徴がある1) (図2)。実際に、MCTはLCTより5倍速く体内で燃焼(分解)されることが報告されている2) (図3)
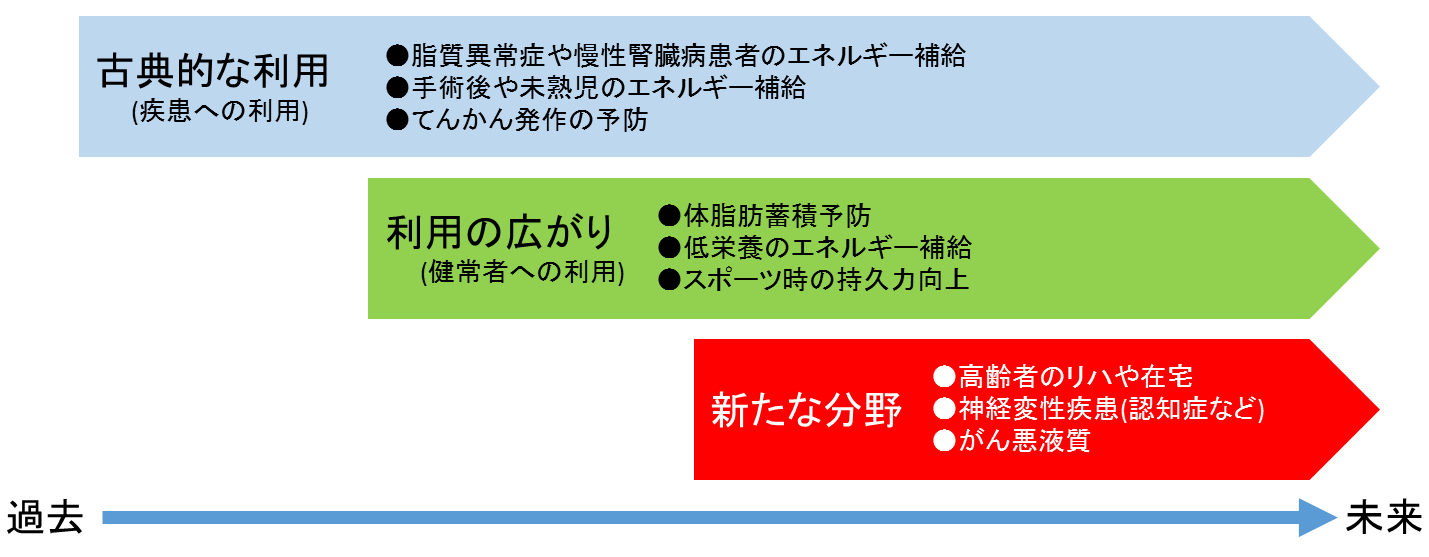
4.MCTの栄養機能に着目した広い領域での活用
MCTは、40年以上前より、エネルギーを積極的に必要とする未熟児や腎臓病患者、高脂肪食(低炭水化物食、ケトン食)を必要とするてんかん患者、低体重の糖尿病患者、長鎖脂肪酸を利用しづらい消化管手術後の患者、などへの栄養補給として、安全性の高さもあり広く利用されてきた3)(図4)。また、健常者の生活習慣病予防や体脂肪低減、スポーツ時の持久力向上などの分野でもMCTの利用が進んでいる。さらには、介護現場においても高齢者の低栄養の改善にMCTが利用され始めている(図5)。

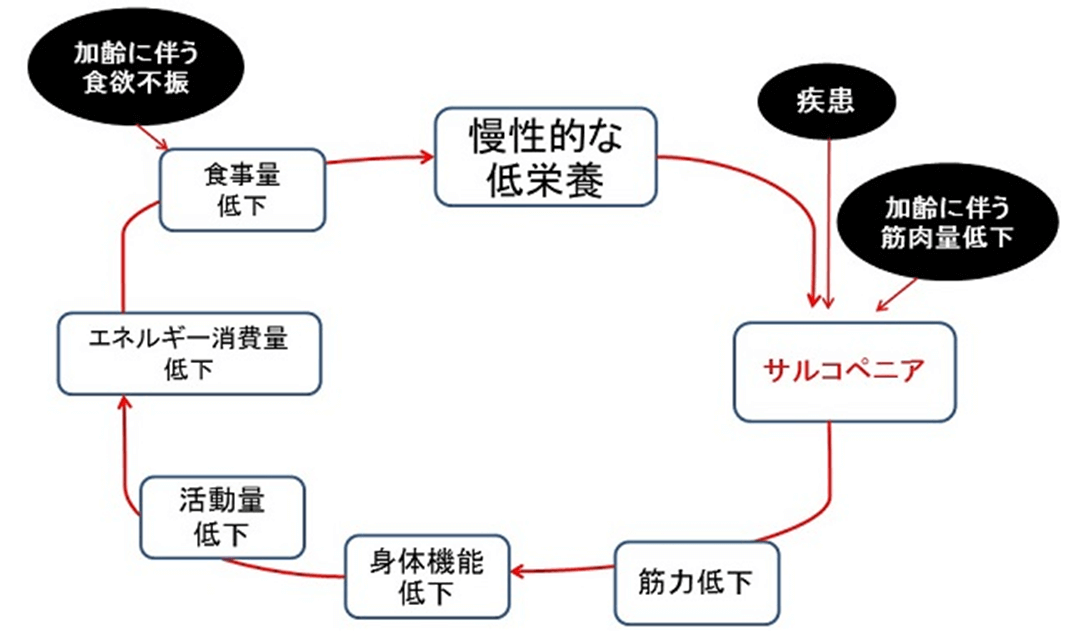
高齢者では、加齢とともに徐々に食欲が低下し、老燕や摂食嚥下障害、サルコペニア、口腔問題、認知症、うつ、独居や貧困などの社会的要因、などが複合的に関与し、フレイルの負のサイクルに陥りやすくなる4)(図6)。フレイルの中核的要因は低栄養であり、少量でエネルギー効率が高いMCTは、低栄養の改善効果に期待できる。
医療現場で利用可能なMCTとして、質の高い(純度100%の)MCTがオイルとパウダーの形態で市販されている(図7)。オイルは透明で味やにおい少なく、素材の風味や外観を損なうことなく利用できる。パウダーは温度に関係なく溶けるため、料理や飲料に混ぜるだけで簡単に無理なくエネルギー補給ができる。MCT補給による副作用としては、用量依存性の下痢が報告されている。低栄養や経口摂取不良の高齢者に対して、一般的な栄養ケアの対応として栄養補助食品が追加提供されることが多いが、MCTをオイルやパウダーの形態で提供することで、摂取すべき食事の量を増やすことなく、また、嚥下対応食の形態を大きく損なうことなく、素早いエネルギー補給が可能である。この視点から、低栄養の患者が多く、必要エネルギーが増大するリハビリテーション(以下、リハ)の分野でのMCTの活用が期待されている。

5.リハビリテーションとMCT
リハを行う高齢者には低栄養が多い。高齢リハ患者の4~8割に低栄養を認め、低栄養はリハの帰結や身体機能と負の関連がある。リハの対象となる身体障害の原因には、脳卒中、転倒による大腿骨近位端骨折、急性疾患治療後の廃用症候群などが挙げられる。それゆえ、高齢リハ患者に対しては全身管理と併存疾患のリスク管理を行いつつ、リハと栄養ケアを同時に行う「リハ栄養」のコンセプトが重要である5)。
リハ栄養におけるMCTの可能性について述べる。MCTはエネルギー効率が高く、すぐにエネルギー源として利用されるため、摂食量が減少し低栄養で低体重の高齢者には極めて有用な栄養素の1つであると考えられる。高齢者には、慢性腎臓病や糖尿病、呼吸不全の合併を少なからず認め、これらの疾患に対してはグルコース主体の栄養補給よりも、MCTを併用したほうが疾患のコントロールにも有利である。つまり、低栄養の高齢者にMCTを活用した栄養ケアは臨床的に有用であると考えられる。さらに、リハを行う高齢者にサルコペニアの合併が多いことも考慮すると、MCTと蛋白質を栄養素として同時に補給することは、高齢者のリハのアウトカムを改善するための栄養管理として理にかなっている。
臨床での活用例を紹介する。熊本リハビリテーション病院において、2012年より低栄養患者に対してMCTと蛋白質を強化した栄養サポートを行っている。低栄養の高齢患者を対象に、二度炊きのライスに、MCTのオイル、パウダー、蛋白質のパウダーを混ぜて「熊リハパワーライス」として提供している(図8)15)。ポイントとしては、ライスに混ぜるだけであるため、誰でも簡単に早く作れること、ボリュームがほとんど変わらないため、食事摂取量が低下した患者に適していること、MCTは無味無臭であるため味を損なわないこと、エネルギーとして即効性があり効率が高いこと、従来の栄養補助にありがちであったグルコース供給過多による慢性腎臓病や糖尿病、呼吸不全の増悪を来さないこと、などが挙げられる。

当院における、脳卒中後に嚥下障害を併発した患者を対象とした、熊リハパワーライス®の臨床効果を検討した結果を図9に示す。この臨床研究は2015年から2016年に連続入院した脳卒中回復期患者204人を対象とした後向きコホート研究である。物性や分量、味や匂いを損なわない工夫で軟飯に中鎖脂肪酸とたんぱく質を混ぜ込んだ熊リハパワーライス®を用い食事管理を行った患者群と、通常の食事管理を行った患者群において、意識状態、嚥下レベル、栄養状態、日常生活自立度(FIM運動)等、12項目の傾向スコアでマッチングした2群間の検討と退院時FIM運動を従属変数とした多変量解析を行った。対象者は204人(平均年齢73.6歳,男性109人,女性95人)、脳梗塞127人、脳出血62人、くも膜下出血15人であった。マッチング後の解析では、熊リハパワーライス®摂取群は非摂取群と比較して多くのエネルギーを摂取し、体重と骨格筋量がより増加し、退院時の常食摂取の割合が高く、FIM運動が高かった(全てp<0.05)。交絡因子を調整した多重回帰分析では、熊リハパワーライス®の摂取は退院時FIM運動に独立して関連していた(β=.169, p=0.02)。つまり、リハを行う高齢者に対するMCTを用いた栄養サポートは、栄養改善や体重増加はもとより、入院期間の短縮やADLの改善効果があることが実証された。(「熊リハパワーライス」は、2016年6月28日付けで商標登録)
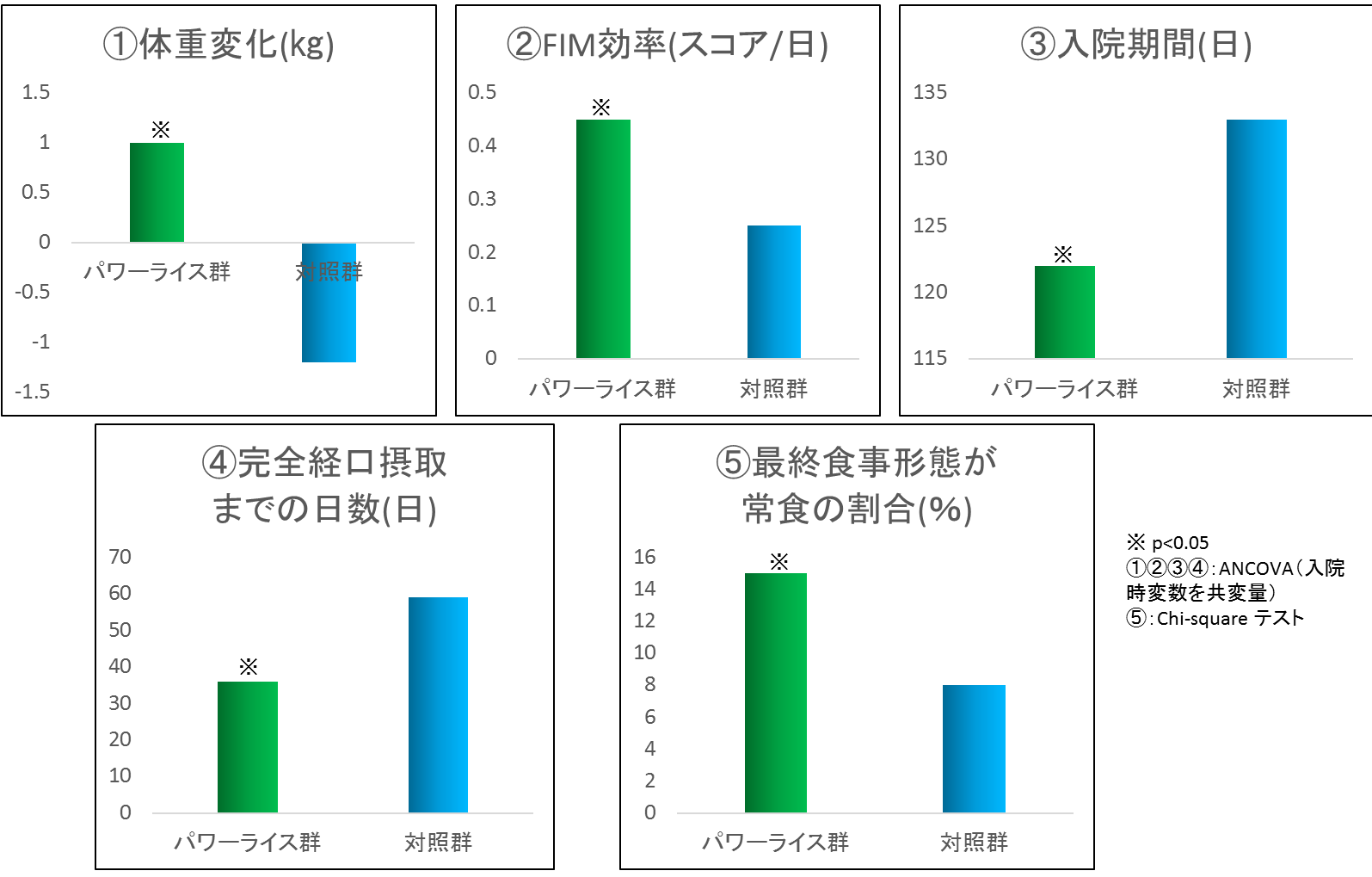
BMI, FIM, Alb, 年齢, 性, 発症からの日数の傾向スコアを用いてペアマッチングしたパワーライス群と対照群を比較。入院時から退院時の変化を2群間で比較したところ、体重変化、FIM効率(FIM利得/入院日数)、入院期間、経口摂取まで日数、最終形態が常食の割合の項目で有意差を認めた。
6.ケトン体と認知症:糖質の代替エネルギーとして①
脂肪酸は肝細胞内のミトコンドリア内に入り、炭素分子が1つおきに酸化されるβ酸化という過程でアセチルCoAを生じてTCA回路(クエン酸回路)で代謝されるが、糖質(ブドウ糖)の供給が少ない環境ではアセチルCoAはケトン体産生に利用される。LCTは糖質が存在するとケトン体の産生が抑制されるが、MCTからケトン体を作る経路は糖質の影響をLCTほど受けないため、MCTからはケトン体が多量に産生される。そのため、脂肪の摂取でMCTの割合を増やすことで、炭水化物の摂取を制限しなくても、ケトン体を多く産生することができる。
ヒトの体内で利用可能なケトン体は、アセト酪酸、βヒドロキシ酪酸、アセトンの総称であり、脂肪酸から肝臓で産生される。ケトン体は、脳だけでなく筋肉や心臓など、肝臓以外の各組織でエネルギー源として利用される。
これまで、脳で利用可能なエネルギーはグルコースのみと考えられてきた。しかし、近年の研究結果より、ブドウ糖欠乏時には脳は肝臓で産生賛成されるケトン体が利用されることが判明している6) (図10)。
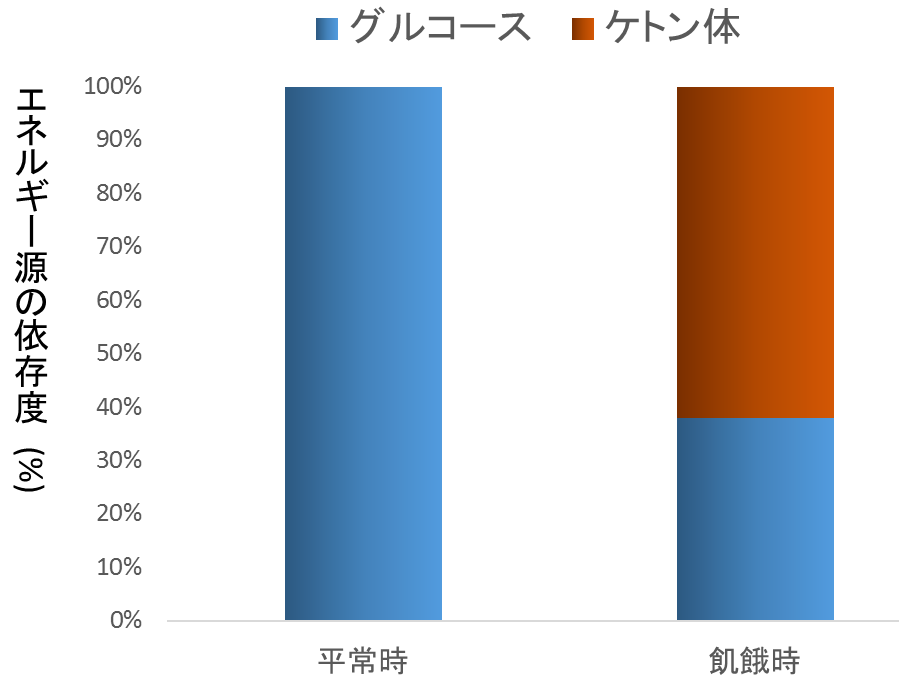
脳が利用するエネルギー源の割合は、平常時はグルコースが100%であるが、飢餓時にはケトン体が約60%を占めている。何らかの要因による栄養障害を合併した高齢者では、脳でのケトン体がグルコースに代替するエネルギーとなっていることが推測される。また、PET検査でアルツハイマー型認知症の脳を解析したところ、健常人の脳と比べて、グルコースの取り込みが著しく減少していた7)。アルツハイマー型認知症では、脳でのグルコースからのエネルギー供給が乏しくなり、その結果、脳細胞の機能障害をきたしている可能性が示唆される。また、1型糖尿病の患者にMCTを投与したところ、血中のケトン体の濃度が上昇し、認知機能の有意な改善を認めた、との介入研究も報告されている8)。
以上より、グルコースが使えずエネルギー欠乏により機能障害をきたしていた脳細胞が、MCTにより産生されるケトン体をエネルギー源として、機能改善が期待できる可能性があり、脳機能の維持のために必要なMCTの量や摂取方法など、さらなる研究が行われている。認知症進行の一因を“脳の低栄養状態”と捉えると、MCTによる認知症の予防や改善効果が期待でき、この領域のますますの研究発展が期待される。
7.ケトン体とがん悪液質:糖質の代替エネルギーとして②
がん細胞ではケトン体をエネルギーに変換する酵素系の活性が低下しているため、ケトン体をエネルギー源として利用できない。また、がん細胞では細胞増殖のために脂肪酸を合成する酵素系の活性が非常に高くなっている一方で、脂肪酸を分解してエネルギーを産生する酵素の活性は低下している。 したがって、体内のグルコース量が減少し、脂肪酸の分解でエネルギーを産生(ATPを合成)している環境では、ミトコンドリアの機能が正常な正常細胞は脂肪酸の代謝によってATPを効率的に産生できるので生存できるのに対し、がん細胞は脂肪酸からATPを産生できないためエネルギーが枯渇して死滅する。
さらに、ケトン体のアセト酢酸とβヒドロキシ酪酸にはそれ自体に抗がん作用があると報告されており、ケトン体ががん細胞のグルコースの取り込みと代謝を阻害するためだと考えられている。
ヒトにおける臨床研究では、進行した小児がん患者(脳腫瘍)にケトン食を提供したところ、血中ケトン体濃度の上昇と悪液質の症状改善、長期生存を認めたという小数症例の介入研究や9)、多形神経膠芽腫に対する抗がん剤治療+放射線治療とケトン食の併用で、著明な抗腫瘍効果を認めたという症例報告10)など、エビデンスレベルは高くないものの、がん患者に対するMCTもしくはケトン食による補助的抗腫瘍効果を示唆する先行研究が散見される。
MCTはがん悪液質の体重減少を防ぎ、抗腫瘍効果が期待できる可能性があり、今後のこの領域のエビデンスの集積が期待される。
8.グレリンとの関連
グレリン(ghrelin)は、1999年に日本人によって発見された胃より分泌されるホルモンで、成長ホルモン刺激作用、摂食刺激作用(食欲亢進)、体重増加をはじめ、多彩な生理活性をもっている。グレリンはアミノ酸28残基のペプチドであり、3番目のセリン残基の側鎖が炭素数8のオクタン酸(カプリル酸)によりアシル化修飾を受けており、グレリンの活性出現にこの修飾が必須であるという特徴をもつ11) (図11)。グレリンの血中濃度は、絶食により上昇し、摂食により低下する。また、肥満患者では低値を示し、低体重の患者では高値を示す。
アミノ基28残基のペプチドであり、3番目のセリンの側鎖が炭素数8のオクタン酸である。
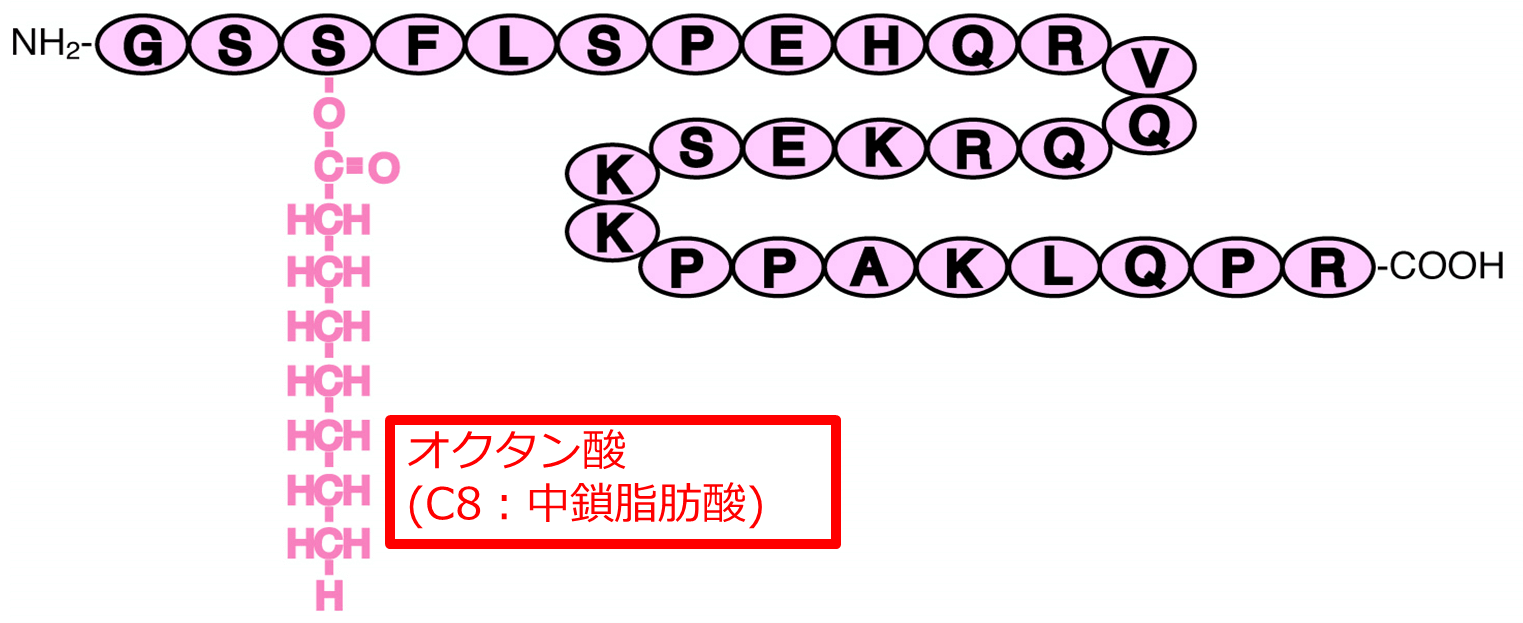
グレリンの発見により、胃が消化機能だけでなく、エネルギー代謝や成長ホルモンの分泌調節にも機能していることが明らかになった。さらに、摂食障害や肥満などの病因におけるグレリンの意義も解明されつつある。MCT(オクタン酸)を摂取することで、血中のアシル化グレリン濃度が上昇することが基礎研究や特定の疾患で 示されていた 12, 13) 。そこで、我々はヒト健常人を対象にMCTとグレリン活性化の研究を試みた。結果として、ヒト健常者が1日45ml(大さじ3杯)のMCTを摂取するとグレリンが有意に(約2倍に)活性化することを見出した14) 。MCT45mlは熊リハパワーライス®のレシピと同量であり、熊リハパワーライス®の摂取で低栄養や低体重の患者の活性化グレリンが上昇し、摂食亢進、体重増加などのグレリンの作用により栄養改善が期待できる可能性がある。もちろん将来的な検証が必要である。がん悪液質の治療に合成グレリンを用いる臨床研究も、本邦ですでに始まっており、グレリンのもつ幅広い生理作用の解明や、薬剤としての臨床応用の研究が急速に進展しつつある。
9.おわりに
本稿では、MCTの生理学的側面について解説し、医療現場での活用例について概説した。認知症やがん患者に対するケトン食の臨床応用や、MCTとグレリンとの関連性については、今後のさらなる臨床研究によるエビデンスの蓄積が期待される。MCTの特性を理解してうまく臨床で活用することで、栄養サポートや栄養ケアのオプションが大きく拡大するものと思われる。
文献
- Bach AC, Babayan VK. Medium-chain triglycerides: an update. Am J Clin Nutr. 1982 Nov;36(5):950-62.
- Furman, R.H. 1968. Effects of medium-chain length triglycerides on serum lipids. Pp. 51–61 in Medium Chain Triglycerides, J.R.Senior, editor. , ed. Philadelphia: University of Pennsylvania.
- 日清オイリオ. 油の機能性成分“中鎖脂肪酸”を学ぼう; 中鎖脂肪酸サロン. http://www.nisshin-mct.com (アクセス日時: 2016年5月31日)
- Fried L.P et al; Frailty in Older Adults Evidence for a Phenotype. J Gerontology, 56: M146-157 2001
- Wakabayashi H, Sakuma K. Rehabilitation nutrition for sarcopenia with disability: a combination of both rehabilitation and nutrition care management. J Cachexia Sarcopenia Muscle. 2014 Dec;5(4):269-77.
- GF Cahill Jr. Fuel metabolism in starvation. 2006. 26: 1-22
- K Herholz. PET studies in dementia. Annals of nuclear medicine, 2003, 17.2: 79-89.
- Page KA, Williamson A, Yu N, McNay EC, Dzuira J, McCrimmon RJ, Sherwin RS. Medium-chain fatty acids improve cognitive function in intensively treated type 1 diabetic patients and support in vitro synaptic transmission during acute hypoglycemia. Diabetes. 2009 May;58(5):1237-44.
- Nebeling LC, Miraldi F, Shurin SB, Lerner E. Effects of a ketogenic diet on tumor metabolism and nutritional status in pediatric oncology patients: two case reports. J Am Coll Nutr. 1995 Apr;14(2):202-8.
- Zuccoli G, Marcello N, Pisanello A, Servadei F, Vaccaro S, Mukherjee P, Seyfried TN. Metabolic management of glioblastoma multiforme using standard therapy together with a restricted ketogenic diet: Case Report. Nutr Metab (Lond). 2010 Apr 22;7:33.
- Lemarié F, Beauchamp E, Legrand P, Rioux V. Revisiting the metabolism and physiological functions of caprylic acid (C8:0) with special focus on ghrelin octanoylation. Biochimie. 2016 Jan;120:40-8.
- Nishi Y, Mifune H, Kojima M. Ghrelin acylation by ingestion of medium-chain fatty acids. Methods Enzymol. 2012;514:303-15.
- Nishi Y, Hiejima H, Hosoda H, Kaiya H, Mori K, Fukue Y, Yanase T, Nawata H, Kangawa K, Kojima M. Ingested medium-chain fatty acids are directly utilized for the acyl modification of ghrelin. Endocrinology. 2005 May;146(5):2255-64.
- Yoshimura Y, Shimazu S, Shiraishi A, et al. Ghrelin activation by ingestion of medium-chain triglycerides in healthy adults: A pilot trial. The Journal of Aging Research and Clinical Practice (JARCP).2018. http://dx.doi.org/10.14283/jarcp.2018.9
- 嶋津 さゆり, 吉村 芳弘, 上野 いずみ, 他. 熊リハパワーライス®は脳卒中回復期の栄養状態や機能的予後を改善する. 学会誌JSPEN. 2019 年 1 巻 3 号 p. 149-156
4.経腸栄養に用いられる製剤及び食品
6.脂肪酸 ② 多価不飽和脂肪酸



