- PDNレクチャーとは?
- Chapter1 PEG
- Chapter2 経腸栄養
- 1.経腸栄養の特徴と適応
- 2.経腸栄養剤の分類
- 3.病態別経腸栄養剤
- 3.1 病態別経腸栄養剤とは?
- 3.2 肝不全用栄養剤
- 3.3 腎不全用栄養剤
- 3.4 糖尿病用栄養剤
- 3.5 呼吸不全用栄養剤
- 3.6 免疫賦活栄養剤、免疫調節栄養剤
- 4.経腸栄養に用いられる製剤および食品
- 4.1 グルタミン製剤(食品)
- 4.2 微量元素製剤
- 4.3 食物繊維
- 4.4 プロバイオティクス、シンバイオティクス
- ① プロバイオティクス
- ② シンバイオティクス
- 4.5 ORS(経口補水液)
- 4.6 増粘剤、ゲル化剤
- 4.7 脂肪酸
- ① 脂肪酸とその分類
- ② 多価不飽和脂肪酸(ω-3, ω-6系)
- ③ 中鎖脂肪酸(MCT)
- 5.半固形化栄養剤
- 5.1 基礎的な知識
- 5.2 臨床的な知識
- ①胃瘻からの半固形化栄養材
短時間注入法 - ②栄養剤形状機能について
- 6.ミキサー食
- 6.1 ミキサー食(成人)
- 6.2 ミキサー食(小児)
- 6.3 ミキサー食(小児)
- 7.早期経腸栄養
- 8.周術期経腸栄養
- 9.在宅経腸栄養
- 9.1 在宅経腸栄養
- 9.2 在宅診療の医療費の実際
- 9.3 終末期医療にかかる費用
- 10.経腸栄養に必要な器具
- 11.経腸栄養時の薬剤投与
- 12.経腸栄養の管理
- 13.経腸栄養の合併症と対策
- 14.栄養剤使用時の栄養アセスメント
- ●「経腸栄養」関連製品一覧
- Chapter3 静脈栄養
- Chapter4 摂食・嚥下リハビリ
- PDNレクチャーご利用にあたって




2022年5月18日改訂
1.早期経腸栄養とは
栄養管理は”If the gut works use it”といわれるように、可能な限り腸管を使用して行うことが推奨されている。さらに侵襲生体、特に重症例において、侵襲後できる限り早い時期から経腸栄養を行うことが生体防御などの点で好ましく、4~5日以上を経過してからの経腸栄養はその効果が低いとされている。
侵襲後早期から積極的に経腸栄養を施行することが、早期経腸栄養法(early enteral nutrition)と呼ばれている。早期経腸栄養法の明確な定義はないが、侵襲後あるいはICU入室後、おおむね24時間以内、遅くとも36(48)時間以内に経腸栄養を開始することをさす場合が多い1)。これまで、早期経腸栄養の臨床効果として、死亡率や感染性合併症の低減、在院期間の短縮などが報告されている。栄養に関する多くのガイドラインが作成されているが、重症な症例に対する栄養管理で共通する最も基本的なことは、可能な限り経腸栄養を行うことと、経腸栄養を24~48時間以内に開始することである2-4)。早期経腸栄養法を実際に施行している施設では、多くが12時間~24時間以内に投与を開始している。
定義: |
侵襲後あるいはICU入室後、おおむね24時間以内、遅くとも36(48)時間以内に経腸栄養を開始すること |
|---|---|
利点: |
感染症の減少、死亡率の低下など |
投与経路: |
多くは胃に投与可能 ハイリスク症例は空腸に投与 |
合併症: |
腹満、腹痛、下痢←速度が速いと起きやすいまれではあるが、腸管気腫や腸管壊死の報告がある |
非適応: |
1)ショック、低酸素血症、消化管出血がコントロールされない場合、2)腸管虚血(NOMI)、3)腸閉塞、4)高度な腸管麻痺、5)腹部コンパートメント症候群など |
2.早期経腸栄養の有用性に関する理論的根拠
2.1 免疫臓器としての腸
腸管が食物を消化し吸収する重要な臓器であることは誰でも知っているが、同時に腸管は人体最大級の免疫臓器である。腸管の免疫組織はGALT(gut associated lymphoid tissue)と総称され、その容積は腸管の25%を占める。また全身の免疫組織の50%以上が腸管に存在する。まさに人体最大の最も重要な免疫臓器なのである5)。
栄養投与経路と腸管免疫は深く関わっていることが知られている。例えばマウスを①静脈栄養、②静脈栄養剤の経腸投与、③半消化態経腸栄養剤で管理すると、腸管リンパ装置のリンパ球数、粘膜IgAレベルは何れも①<②<③の順となっており、栄養投与経路や栄養の形態が免疫能に大きな影響を及ぼすことが明らかにされている6)。
2.2 腸管のバリアー機能
腸管内には100兆個におよぶ多種多様の微生物や細菌毒素、食事性抗原などが存在するものの、腸管にはバリアー機能が備わっており、通常はこれらが生体内へ入り込むのを阻止している。しかし、広汎熱傷、出血性ショック、重症膵炎など、さまざまな重篤な病態下では、腸管のバリアー機能が破綻することがあり、その結果、細菌などが腸間膜リンパ節、肝、脾あるいは全身へ侵入する。この現象はbacterial translocation(以下BT)とよばれ、腸管のバリアー機能の破綻のよい指標となる。ヒトでは未だ議論はあるが、これまで数多くの動物実験でBTが確認され、全身感染やseptic MOF (multiple organ failure) の原因、あるいは促進因子となることが指摘されている7)。
我々が以前行った動物実験では、BTは侵襲後24時間以内の早い時期から起こっており、この時期に経腸栄養を行うとBTが抑制され生存率も改善した8)。即ちBTの観点からみると、早期経腸栄養が有効であり、時日を経てから経腸栄養を行うのでは早期のBTを抑制できず効果が低いことになる。また静脈栄養、消化態経腸栄養剤、通常食の順にBTが促進されており、BT防止の観点からbulkのある食物の腸管内投与が有効であると考えられる。
3.早期経腸栄養の有用性に関する臨床的エビデンス
3.1 腹部外科手術後
早期経腸(経口)栄養 vs 古典的な絶食管理
古典的な腹部外科手術後管理は、術後胃管を留置して減圧し、排ガスがあるまで経腸(経口)摂取を禁じてきた。しかし、多くの臨床試験でこの管理方法は否定され、早期経腸(経口)栄養の有用性が示されてきた。2009年に報告されたmeta-analysisでは、腹部外科手術後24時間以内に経腸(経口)栄養を開始した群と、古典的な絶食群とを比較した13のRCT、1,173例を検討し、早期経腸栄養群で死亡率が有意に低く、また何れも有意差には至らないものの、肺炎、創感染、腹腔内膿瘍、縫合不全、在院日数が早期経腸栄養群で少なく、嘔吐が多くなっていた9)。
消化管吻合部の上流から栄養を投与した上部消化管症例に限ったmeta-analysis(1240症例が対象)でも、24時間以内の早期経腸(経口)栄養群で有意に術後合併症が少なく(OR 0.55; CI 0.35-0.87, P=0 .01)、縫合不全の発生率も有意差はないものの良好であったと報告されている(OR 0.75; CI 0.39–1.4, P=0.39) 10)。最新の下部消化管手術患者(トライツ靭帯より肛門側の腸管手術患者)を対象とした2019年のmeta-analysis では、24時間以内の早期経腸栄養群で在院期間が平均 1.95日、有意に短くなっていたが、生存率や術後合併症発生率などの差は認められなかった11)。
待機的な外科手術においては、近年ERASプロトコルの導入により、比較的早期の経口摂取開始が定着してきている。2018年に行われた我が国のアンケート調査では、食道を除く主要な消化管術後の食事開始時期は、おおむね5割が3日以内、7割が4日以内であり12)長期間絶食とする、いわゆる古典的な術後管理はすでに過去のものとなっているのが現実と思われる。一方、ERASの原法では手術翌日からの経口摂取が推奨されており、このような早期経口摂取が安全に施行できるかが最近の大きな関心事になっている。この点に関して、多くの報告で、ERAS管理下において早期経口摂取が安全に施行できることが示されている。しかし、特に上部消化管術後患者においては、早期経口摂取が可能であっても十分量の摂取ができない、あるいは摂取することが好ましくない患者も少なからず存在するので、この点、十分にモニターし対処する必要がある。
3.2 ICU患者
外科手術後、外傷、熱傷、膵炎(後述)、敗血症などのICU患者で早期経腸栄養の有用性が報告されており、種々ガイドラインで早期経腸栄養が推奨されている2-4)。カナダのpractice guidelineは、Heylandらが中心となってランダム化比較試験(以下RCT)のmeta-analysisに基づいて作成され2003年に誌上発表されたが13)、meta-analysisの結果はCritical Care Nutritionというウエッブサイト上で常に更新されている(https://www.criticalcarenutrition.com)。
1)早期経腸栄養vsそれ以外(静脈栄養を含む)
Critical Care Nutrition の2021年5月の更新情報では、ICU入室後48時間以内に経腸栄養を開始した群と、48時間以降に何らかの栄養を開始した群(静脈栄養も含まれる)を比較すると、前者で死亡率(RR 0.70, 95% CI 0.50, 0.97, p=0.03)、感染症発生率(RR 0.83, 95% CI 0.71, 0.97, p=0.02)ともに有意に良好であった(https://www.criticalcarenutrition.com)。
一方、2018のTian、Doigらのmeta-analysisでは、3225症例が集積されICU入室後24時間以内に経腸栄養を開始した群と、それ以外の栄養方法(静脈栄養、遅れての経腸栄養を含む)を比較した結果、両群で生存率に有意差は認められなかったが(odds ratio, 1.01; 95% CI, 0.86–1.18; p = 0.91)、肺炎の発生率は早期経腸栄養群で有意に低かった(odds ratio, 0.75; 95% CI, 0.60–0.94; p = 0.012)14)。
2)早期経腸栄養vs遅れての経腸栄養
早期経腸栄養と遅れての経腸栄養の比較では、古くは2001のMarikらのmeta-analysisがある15)。これは、外科手術後あるいはICU入室後36時間以内に経腸栄養を開始した場合とそれ以降に経腸栄養を開始した場合を比較した15のRCT、753症例を検討したものである。その結果、早期経腸栄養群で、感染性合併症が約半分に有意に減少し(19% vs 41%、RR 0.45)、在院日数が2.2日間有意に短縮したとしている。また、先のTian、Doigらのmeta-analysisにおけるsubgroup解析では、対象症例が各群100例前後と少ないものの、死亡率や肺炎発生率において早期経腸栄養群が有意に良好であった14)。
3)早期経腸栄養vs静脈栄養(TPN)
1992年、Kudskらは多数の外傷患者を対象にRCTを行い、平均24時間で経腸栄養を開始した症例では、ほぼ同時期にTPNを開始した症例に比べて、術後の肺炎発生率(11.8%vs31%)や膿瘍発生率(3.9%vs17.8%)が有意に低下すると報告し、TPNが広く行われていた時代の栄養管理のあり方に大きな影響を与えた16)。そして以後、多くの類似研究結果をもとに、ICU患者における栄養管理の基本は早期経腸栄養であるとの広いコンセンサスを得るに至ったのである。
しかしその後の研究では、TPNで感染性合併症が多いのは、TPNで高血糖やoverfeedingが起こっているためではないかとの見解も見られるようになった。2016のElkeらのmeta-analysisや、2021年にupdateされたCritical Care Nutritionのmeta-analysisでは、静脈栄養でエネルギー投与量が多い場合は、有意に感染性合併症が多くなったが、両群でエネルギー投与量が同等の場合は、感染性合併症発生率に差が認められないという結果であった17)(http://www.criticalcarenutrition.com/)。いずれも、死亡率に差は認められなかった。すなわち、TPNは高血糖やoverfeedingが起きやすいことがひとつの大きな問題点であるということであろう。
4)急性重症膵炎
急性膵炎では、膵における消化酵素の分泌を刺激しないために、従来は経静脈栄養が行われ、経腸栄養は行うべきではないとする意見が支配的であった。しかし多くのRCTの結果、早期経腸栄養の有用性が示され、種々ガイドラインで早期経腸栄養の施行が推奨されるようになっている18,19)。栄養剤の種類は半消化態でも消化態でも問題なといする見解が多い。しかし、栄養をトライツを越えた空腸へ投与することと消化態栄養剤を使用すれば膵外分泌があまり刺激されないことが報告されており、心配な場合は空腸へ消化態栄養剤を投与すれば良いだろう20)。
一方、重症例では、腸閉塞、腹部コンパートメント症候群、腸管虚血、遷延する腸管麻痺など、経腸栄養が適応的できない場合が20%近くあるとの指摘もあり、このような場合は躊躇なく静脈栄養を施行すべきである18)。
4.早期経腸栄養施行に関する臨床的な危惧
4.1 開腹手術と消化管吻合
古典的な絶食管理は開腹術後の腸管麻痺を考慮したものである。しかしRothnieらによれば、開腹手術後の腸管蠕動回復に要す時間として小腸で6~12時間、胃で12~24時間、大腸で48~120時間とされており21)、腸管麻痺の観点からは、小腸内であればほぼ手術当日から、胃内であっても術後24時間以降には食物が入っても問題がないことになる。
消化管吻合に関しては、早期に経口•経腸栄養を行って吻合部を食物が通ったからといって縫合不全が増えるというエビデンスはない。前述の3.1で示したmeta-analysisでは、有意差はないものの、縫合不全発生率は早期経腸栄養群で低いと報告されている9,10)。
一方、動物実験でTadanoらは、消化管吻合部の創傷治癒プロセスを促進するためには,絶飲食は逆効果であり,早期経口摂取にて神経芽細胞に適切なMechanical loading(機械的な荷重)が加わることで,消化管吻合部の創傷治癒を促進すると報告している22)。Khaliliらの動物実験でも早期の栄養が吻合部の耐圧強度を大きくすると報告されており23)、このことを裏付けている。
4.2 ICU患者
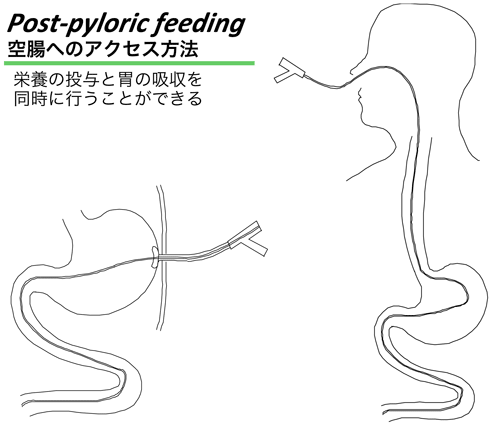
ICUの重症患者で腸管麻痺はしばしば経験する。このような場合でも、麻痺の主体は胃であるとされ、栄養を直接小腸に投与すれば早期経腸栄養が可能である。ダブルルーメンのチューブを挿入すれば、胃の麻痺が強い場合でも胃の吸引と空腸への栄養投与を同時に施行することができる(図1)。内視鏡を使用するなどして、ICUで効果的に栄養チューブを挿入する方法が種々考案されているが24)、入室24時間以内に空腸まで挿入するのは、特に慣れない施設では必ずしも容易ではなく、これが早期経腸栄養施行の障害となっている。しかし、実際には胃に投与しても多くの症例で大きな問題がないことも多々報告されており、ルーチンに経空腸投与を試みる必要はない25)。また早期に栄養を投与しないことが腸管麻痺を招く原因となることもある。例えば重症熱傷患者では、早期の経腸栄養の認容性は良好であるが、早期に経腸栄養を行わないとその後の経腸栄養の投与が困難になることが指摘されている。
5.早期経腸栄養の実際
5.1 投与経路(胃か空腸か)
前述したように、早期経腸栄養では、胃の運動が回復していないことが多いので、幽門輪を越えた位置にチューブを挿入するpostpyloric feedingが推奨されてきた。しかし、経胃投与と経腸投与を比較して、誤嚥性肺炎の発生頻度や栄養投与量に関しても差がないとする複数の報告も多く26)、meta-analysisでも死亡率や肺炎の頻度に差は認められていない27)。従って、多くの症例では経胃投与で問題がないと考えられる。また胃に投与する際にerythromycinやmetoclopramideなどの蠕動亢進薬の有用性も指摘されている28)。
一方、明らかに胃の残渣が多い症例、排泄遅延のハイリスク症例では、トライツを越えた空腸からの投与を行うべきである29)。またこの際には、胃吸引の積極的な併用も考慮すべきであろう。いわゆるpostpyloric feedingといわれるものは十二指腸への投与も含まれるが、十二指腸への投与では栄養剤の胃への逆流が少なからず認められる。またチューブが反転したりして、胃へ戻ってしまうことも少なくない。
空腸への栄養投与は、経鼻的に胃を経由してチューブを挿入するか、開腹下に直接腸瘻チューブを挿入して行う。または、経皮的胃瘻(PEG)や経皮経食道的胃瘻(PTEG)を介してチューブを送り込む。この際にも、胃の運動促進薬として作用するerythromycinを使用すると、チューブの留置が容易になるとの報告が認められる(図1、2)。
5.2 投与栄養剤
現在の市販の栄養剤は、消化態栄養剤(Elemental Diet ED, ペプチド)、と半消化態栄養剤に大別される。一般に消化吸収能が保たれている場合は、腸管の免疫能維持やbacterial translocationを防止するという意味合いから、bulkのある半消化態が望ましい。一方、栄養がトライツより60cm以上肛門側に投与されると、通常に比べて膵液の分泌が悪いことが報告されており、これには消化管ホルモンpeptide YYやGLP-1の関与が指摘されている。したがって、このような場合は消化態栄養剤の投与も選択肢となる30)。また、膵臓が切除された場合(膵頭十二指腸切除後など)など、消化機能の障害が想定される場合、消化態栄養剤の使用が推奨される。
5.3 投与スケジュール
早期経腸栄養では、はじめは緩徐な速度(15~20ml/hour)で開始し、徐々に増量して目標量とすることが肝要である。性急に増量すると腹満や下痢などの消化管症状が出現しやすい。初期には内因性のエネルギー供給も多いので、overfeedingになりやすいということもある。また、後述する重篤な合併症である腸管虚血発生が初期投与量が多い場合に起きやすいのではないかとの指摘もある31)。
速度を適切に保つためにはポンプの使用が推奨される。緩徐な速度で長時間にわたり経腸栄養剤を投与するので、栄養剤の細菌汚染には特に注意が必要である。細菌汚染が下痢の原因となることも多い。液状の栄養剤は原則として水で薄めずに使用、容器から直接閉鎖回路を通じて投与するのが望ましい。栄養剤を容器へ移して使用する場合は、1日量を数回に分けて行い、つぎ足しをしてはいけない。
6.早期経腸栄養の合併症
最も多い合併症は腹満、腹痛、下痢といった腹部症状である。特に小腸内に直接投与した場合は、速度が速いとこのような合併症が起きやすい。侵襲の程度、輸液量、低アルブミン血症など、多くの要因がこれらと深く関わっているとされる。硬膜外麻酔は痛みなどによる交感神経系刺激を抑制し、早期経腸栄養の認容性を改善する。また胃の機能が保たれている場合に胃内投与すれば、貯留能が生かされ下痢や腹満は減少する。しかし、すでに述べたように侵襲早期は胃の麻痺が起こることも多く、その結果、嘔吐や逆流が起きやすく、誤嚥性肺炎にも注意が必要である。
空腸瘻の合併症として腸閉塞がある。その発生頻度は、500中1例(0.2%)32)、2022例中3例(0.15%) 33)、Braga402例中2例(0.5%)34)などと低いものが多い。一方、食道癌術後で空腸瘻と経鼻経管栄養を比較したmeta-analysisでは、空腸瘻1338例中34例(2.5%)、経鼻経管栄養で1147例中 4中(0.3%)であった35)。
腸管壊死は、頻度は低いが最も重篤な合併症で死亡率は80%以上と報告されている36)。一般に経腸栄養は腸管—門脈系の血流を増やし、腸管の構造や機能の維持に有用とされるが、循環動態が不安定な重症患者に経腸栄養を行うと、栄養投与によるエネルギーや酸素必要量の増加がまかないきれず、相対的虚血状態、すなわちNOMI (non-occlusive mesenteric ischemia)が誘発され、非血管閉塞性の腸管壊死(NOBN: non-occlusive bowel necrosis)が生じることがあるとされる。外科手術やICU患者の早期経腸栄養における発生頻度は0.15-3.5%、内科系より外科系で高い傾向にあるとされる。2011 年以降の7つの大規模RCTで、昇圧薬投与と早期経腸栄養を受けた12,219例では、36 例 (0.3%)にNOMI が発生していた36)。どのような症例がNOMI やNOBNを起こしやすいかという明確な基準はないが、昇圧薬投与量が多いこと、経腸栄養の量が多いこと(full dose 投与)との関連も指摘されている31)。ショックから離脱していれば、昇圧薬投与中であっても経腸栄養は可能とする意見が大勢であるが、このような症例では、経腸栄養は特に少量から開始して入念なモニタリングが必要である。しかし、NOMIの早期診断は必ずしも容易ではない。
文献
- 福島亮治: 早期経腸栄養. 経腸栄養バイブル 2007, 19-22. 丸山道生編著. 日本医事新報社.
- McClave SA, Taylor BE, Martindale RG, et al: Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr 2016, 40:159-211.
- Reintam Blaser A, Starkopf J, Alhazzani W, et al: Early enteral nutrition in critically ill patients: ESICM clinical practice guidelines. Intensive Care Med 2017, 43:380-398.
- Singer P, Blaser AR, Berger MM, et al: ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 2019, 38:48-79.
- 福島亮治: 生体における腸管免疫の重要性. 臨床外科 2009, 64:1333-1338.
- Li J, Kudsk KA, Gocinski B, et al: Effects of parenteral and enteral nutrition on gut-associated lymphoid tissue. J Trauma 1995, 39:44-51; discussion 51-42.
- 福島亮治: 腸管のバリア機能と早期経腸栄養. 小児外科 2008, 40.
- 小林暁: 開腹手術後の早期経腸栄養の有用性 -術後second attackに対するサイトカイン反応や bacterial translocationからみた検討-. 外科と代謝栄養 2005, 42.
- Lewis SJ, Andersen HK, Thomas S: Early enteral nutrition within 24 h of intestinal surgery versus later commencement of feeding: a systematic review and meta-analysis. J Gastrointest Surg 2009, 13:569-575.
- Osland E, Yunus RM, Khan S, et al: Early versus traditional postoperative feeding in patients undergoing resectional gastrointestinal surgery: a meta-analysis. JPEN J Parenter Enteral Nutr 2011, 35:473-487.
- Herbert G, Perry R, Andersen HK, et al: Early enteral nutrition within 24 hours of lower gastrointestinal surgery versus later commencement for length of hospital stay and postoperative complications. Cochrane Database Syst Rev 2019, 7:CD004080.
- 深柄和彦, 福島亮治: WEBアンケート調査から見る外科医のアルブミンに対する認識と術後の栄養管理の現状. 外科と代謝栄養 2021, 55:141-150.
- Heyland DK, Dhaliwal R, Drover JW, et al: Canadian clinical practice guidelines for nutrition support in mechanically ventilated, critically ill adult patients. JPEN J Parenter Enteral Nutr 2003, 27:355-373.
- Tian F, Heighes PT, Allingstrup MJ, et al: Early Enteral Nutrition Provided Within 24 Hours of ICU Admission: A Meta-Analysis of Randomized Controlled Trials. Crit Care Med 2018, 46:1049-1056.
- Marik PE, Zaloga GP: Early enteral nutrition in acutely ill patients: a systematic review. Crit Care Med 2001, 29:2264-2270.
- Kudsk KA, Croce MA, Fabian TC, et al: Enteral versus parenteral feeding. Effects on septic morbidity after blunt and penetrating abdominal trauma. Ann Surg 1992, 215:503-511; discussion 511-503.
- Elke G, van Zanten AR, Lemieux M, et al: Enteral versus parenteral nutrition in critically ill patients: an updated systematic review and meta-analysis of randomized controlled trials. Crit Care 2016, 20:117.
- Arvanitakis M, Ockenga J, Bezmarevic M, et al: ESPEN guideline on clinical nutrition in acute and chronic pancreatitis. Clin Nutr 2020, 39:612-631.
- Mederos MA, Reber HA, Girgis MD: Acute Pancreatitis: A Review. JAMA 2021, 325:382-390.
- Hegazi R, Raina A, Graham T, et al: Early jejunal feeding initiation and clinical outcomes in patients with severe acute pancreatitis. JPEN J Parenter Enteral Nutr 2011, 35:91-96.
- Rothnie NG, Harper RA, Catchpole BN: Early postoperative gastrointestinal activity. Lancet 1963, 2:64-67.
- Tadano S, Terashima H, Fukuzawa J, et al: Early postoperative oral intake accelerates upper gastrointestinal anastomotic healing in the rat model. J Surg Res 2011, 169:202-208.
- Khalili TM, Navarro RA, Middleton Y, et al: Early postoperative enteral feeding increases anastomotic strength in a peritonitis model. Am J Surg 2001, 182:621-624.
- Zick G, Frerichs A, Ahrens M, et al: A new technique for bedside placement of enteral feeding tubes: a prospective cohort study. Crit Care 2011, 15:R8.
- Berger MM, Soguel L: Feed the ICU patient 'gastric' first, and go post-pyloric only in case of failure. Crit Care 2010, 14:123.
- White H, Sosnowski K, Tran K, et al: A randomised controlled comparison of early post-pyloric versus early gastric feeding to meet nutritional targets in ventilated intensive care patients. Crit Care 2009, 13:R187.
- Zhang Z, Xu X, Ding J, et al: Comparison of postpyloric tube feeding and gastric tube feeding in intensive care unit patients: a meta-analysis. Nutr Clin Pract 2013, 28:371-380.
- Ridley EJ, Davies AR: Practicalities of nutrition support in the intensive care unit: The usefulness of gastric residual volume and prokinetic agents with enteral nutrition. Nutrition 2011, 27:509-512.
- Silk DB: The evolving role of post-ligament of trietz nasojejunal feeding in enteral nutrition and the need for improved feeding tube design and placement methods. JPEN J Parenter Enteral Nutr 2011, 35:303-307.
- Silk DB: Formulation of enteral diets for use in jejunal enteral feeding. Proc Nutr Soc 2008, 67:270-272.
- Reignier J, Boisrame-Helms J, Brisard L, et al: Enteral versus parenteral early nutrition in ventilated adults with shock: a randomised, controlled, multicentre, open-label, parallel-group study (NUTRIREA-2). Lancet 2018, 391:133-143.
- Sarr MG: Appropriate use, complications and advantages demonstrated in 500 consecutive needle catheter jejunostomies. Br J Surg 1999, 86:557-561.
- Myers JG, Page CP, Stewart RM, et al: Complications of needle catheter jejunostomy in 2,022 consecutive applications. Am J Surg 1995, 170:547-550; discussion 550-541.
- Braga M, Gianotti L, Gentilini O, et al: Feeding the gut early after digestive surgery: results of a nine-year experience. Clin Nutr 2002, 21:59-65.
- Li HN, Chen Y, Dai L, et al: A Meta-analysis of Jejunostomy Versus Nasoenteral Tube for Enteral Nutrition Following Esophagectomy. J Surg Res 2021, 264:553-561.
- Patel JJ, Rice T, Heyland DK: Safety and Outcomes of Early Enteral Nutrition in Circulatory Shock. JPEN J Parenter Enteral Nutr 2020, 44:779-784



